Виды и особенности автомобильных катализаторов •
Виды и особенности автомобильных катализаторов
Все каталитические нейтрализаторы, устанавливаемые в выхлопной системе автомобиля с целью дожигания отработанных газов и увеличения уровня экологической безопасности выхлопа, делят на две большие группы: керамические и металлические. Особняком в этой классификации стоят сажевые фильтры. В чем разница межу ними?
Керамические катализаторы
Картридж этого устройства, находящийся внутри корпуса, изготовлен из керамики. Его соты имеют правильную квадратную, круглую либо треугольную форму, являются сквозными, поэтому хорошо просматриваются на свет, если, конечно, не забились в процессе эксплуатации ката. В целом, картридж керамического катализатора имеет вид решетки.
Достоинством этого типа нейтрализаторов является относительно доступная стоимость. А главный недостаток – хрупкость: устройство может выйти из строя от сильного удара, например, при попадании в большую яму, от контакта с водой – если автомобиль въехал в глубокую лужу, а также от неисправности системы зажигания.
В случае, если при повреждении целостность корпуса была нарушена, такой катализатор могут даже не принять на утилизацию в скупке.
Металлические катализаторы
Они намного более прочны, надежны, долговечны, устойчивы к влаге и механическим воздействиям, поэтому и стоят существенно дороже керамических. Конструктивно картридж металлического каталитического нейтрализатора выглядит как спиралевидная ячеистая структура с металлическими сотами неправильной формы.
Основными причинами выхода из строя такого устройства являются некачественное топливо, сильный перегрев либо естественная выработка рабочего ресурса. А вот удары ему не страшны – отрикошетивший от дорожного покрытия камень, в худшем варианте развития событий, оставит после себя вмятину, но корпус автоката не пробьет.
Сажевые фильтры
Подобные приспособления устанавливаются только на авто, которые функционируют на дизельном топливе. Их квадратные ячейки – открытые и закрытые – чередуются в шахматном порядке и структурированы в блоки.
Сажевый фильтр стоит дешевле металлического катализатора, но и раскалывается от ударных воздействий так же легко, как и автокат с керамическим картриджем. Весит, кстати, он больше, чем каталитический нейтрализатор для бензинового транспортного средства.
Виды нейтрализаторов выхлопа по месту установки
Помимо вышеописанной, существует еще одна классификация катализаторов – по особенностям размещения. Устройство может располагаться на приемной трубе или непосредственно после нее, перед основным резонатором. Такой вариант является оптимальным: вышедший из строя катализатор легко снимается и заменяется новым – оригинальным либо универсальным. И даже если автовладелец предпочтет остановится на обманке – ее монтаж в этом случае не вызовет сложностей.
Гораздо менее перспективна ситуация, в которой каталитический нейтрализатор установлен прямо в выпускном коллекторе и является его частью. Преимуществом такого конструктива считается то обстоятельство, что разогревание ката до нужных температур занимает меньше времени, нежели у устройства, размещенного непосредственно на выпускной трубе.
При этом потенциально он считается неремонтопригодным, хотя умельцы все же находят способы решить проблему. Тем не менее, процедура замены выработавшего рабочий ресурс устройства на новое отличается повышенной сложностью, а при выборе пламегасителя его приходится интегрировать непосредственно в корпус бывшего катализатора.
Кроме того, расположенный таким образом автокат может выйти из строя просто при перегреве выпускного коллектора, что также говорит не в пользу практичности подобной конструкции.
Катализаторы — Что такое Катализаторы?
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы — вещества, изменяющие скорость химической реакции и не входящие в состав конечных продуктов.См. Спецпроект Neftegaz.RU «Национальный продукт: Отечественные катализаторы».
Катализаторы обеспечивают энергетически менее затрудненные пути реакции, что позволяет эффективно использовать сырье.
Катализ — это ускорение химических реакций под действием малых количеств веществ (катализаторов), которые сами в ходе реакции не изменяются.
Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс).
Примерно 90% объема современного химического производства основано на каталитических процессах.
Катализаторы позволяют превратить низкосортное сырье в высокоценные продукты.
Например, в каталитическом крекинге — одном из ключевых процессов, обеспечивающих увеличение выхода светлых нефтепродуктов (особенно бензина), самое главное действие катализатора — расщепление больших углеводородных молекул на более мелкие с высоким октановым числом.
Гидрокрекинг в свою очередь — процесс получения высококачественных керосиновых и дизельных дистиллятов из тяжелого газойля вакуумной перегонки и вторичных процессов.
Он также позволяет получить высококачественную основу базовых масел, близкую по эксплуатационным характеристикам к синтетическим.
Иначе говоря, это каталитический крекинг в присутствии водорода — где сочетание водорода, катализатора и соответствующего режима процесса позволяют провести крекинг низкокачественного легкого газойля и добиться получения высококачественных основ для широкого ассортимента товарных смазочных масел.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
- постоянная высокая каталитическая активность,
- селективность,
- механическая прочность,
- термостойкость,
- устойчивостью к действию каталитических ядов,
- большая длительность работы,
- легкая регенерируемость,
- необходимые гидродинамические характеристики,
- невысокая стоимость.

Формирование свойств катализатора происходит во время его приготовления и во время эксплуатации, поэтому метод приготовления катализатора должен учитывать возможность образования активных центров в условиях катализа. Во многих случаях активность промышленных катализаторов увеличивают добавлением промоторов (сокатализаторов).
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
 Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.

Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Виды автомобильных катализаторов и Прием отработанных катов
Экологическая ситуация в мире отнюдь не является благополучной. За последние столетия показатели загрязненности окружающей среды выросли во много раз. Особенно резкий скачок произошел после массового распространения автомобильного транспорта.
В крупных городах России, по последним результатам экологической экспертизы, более 50% от общего загрязнения составляют вредные вещества, которые продуцируются из выхлопных газов автомобилей. В развитых европейских странах обстановка немного лучше. Чем же вызвано это различие?
Дело в том, что в автотранспорте, который получил распространение за рубежом, в обязательном порядке устанавливается катализатор – устройство, минимизирующее содержание вредных соединений, таких как CH, CO и NO в выхлопах. При его использовании содержание данных веществ в газах, которые выбрасываются в атмосферу при работе автомобиля, не превышают нормы, установленные правилами экологической безопасности.
Катализаторы: какие они бывают?
На данный момент в автомобили может быть установлен катализатор одного из следующих видов:
- Керамический. Данный катализатор дожигания – это керамическая сотовая конструкция. Но в состав материала, из которого изготавливается прибор, входят и более дорогие детали: платина, радий и палладий. Отчасти из-за содержания данных металлов керамический катализатор особо ценится организациями, который осуществляют прием катализаторов.
Данный тип устройств устанавливается на большинство автомобилей, которые завозятся в Россию из зарубежных стран. Можно поставить такой катализатор и на отечественный автомобиль, но это далеко не каждому по карману.
Работа прибора в условиях нашей страны связана с определенными трудностями: плохие дороги, качество бензина отнюдь не способствуют бесперебойной работе керамических сот. Из-за этого прибор часто приходится менять, но существенным плюсом является тот факт, что скупка катализаторов, цена на которые довольно высока, осуществляется многими фирмами.
- Химические. Второе название этого типа приборов – присадки. Они используются в основном для того, чтобы усилить свойства топлива масел и повысить устойчивость некоторых деталей автомобилей. Производители предлагают широкий ассортимент данных катализаторов. Но при его использовании есть один существенный недостаток: скупка катализаторов данного типа, пришедших в негодность, не осуществляется. Его можно просто выбросить. А значит, возместить часть стоимости довольно дорогого устройства не получится.
- Магнито-стрикционный. Самая современная разработка, которая, скорее всего, ляжет в основу технологии создания нового класса автомобилей. Они не меняют химического состава топлива, а улучшают присущие ему физические свойства. При использовании данного типа катализаторов экологичность автомобиля увеличивается в 3-4 раза.
Какой вид устройства установить на свой автомобиль решает каждый водитель самостоятельно. Но перед тем как выбросить старый прибор, стоит отнести его в пункт приема катализаторов: денежная сумма, вырученная за его продажу, поможет улучшить настроение, испорченное поломкой детали.
Но перед тем как выбросить старый прибор, стоит отнести его в пункт приема катализаторов: денежная сумма, вырученная за его продажу, поможет улучшить настроение, испорченное поломкой детали.
что это, зачем он нужен, устройство, принцип работы, виды
Выхлопная система современного авто, произведенного за рубежом или собранного по лицензии в России, намного сложнее того, что отечественный автопром устанавливал еще пару десятилетий назад на «Лады» собственного производства.
Выбросы автомобилей в атмосферу
Незаменимые в быту и хозяйственной деятельности человека автомобили представляют наибольшую опасность для среды обитания человека. Вредное воздействие продуктов сгорания автомобильных двигателей имеет глобальные и локальные последствия:
- Глобальные. Толщина и площадь озонового слоя, защищающего Землю от космических излучений, за последние десятилетия катастрофически уменьшилась, что в перспективе создает опасность для существования человечества.

- Локальные. В мире есть еще немало территорий с чистой экологией. Но это никак не касается городов, где уже сегодня дышать чистым воздухом практически невозможно.
Как в этих процессах участвуют наши автомобили? Самым непосредственным образом! Их доля в загрязнении окружающей среды составляет не менее 70%. Всего за один год эксплуатации среднестатистический автомобиль выбрасывает в атмосферу:
- 135 кг окиси углерода;
- 25 кг оксидов азота;
- 20 кг углеводородов;
- 4 кг двуокиси серы;
- 1,2 кг твердых частиц;
- до 10 кг бензопропилена.
Всего получается не менее 12 миллионов тонн веществ, которые уничтожают не только среду обитания человека, но и разрушают защитный озоновый слой планеты. С каждым годом количество автомобилей увеличивается, что в перспективе не сулит ничего хорошего.
В связи с этим на международном уровне приняты стандарты качества топлива и количества вредных веществ, попадающих в атмосферу в процессе его сгорания в автомобильном двигателе. С 2005 года в странах Евросоюза установлен экологический стандарт Евро-5 для всех производимых транспортных средств. В России переход на стандарт Евро-4 осуществлен в 2015 году.
С 2005 года в странах Евросоюза установлен экологический стандарт Евро-5 для всех производимых транспортных средств. В России переход на стандарт Евро-4 осуществлен в 2015 году.
Зачем нужен катализатор
Каталитический нейтрализатор выхлопных газов – элемент выхлопной системы автомобиля, ответственный за нейтрализацию вредных для экологии продуктов сгорания бензина – углеводородов, окисей азота и углерода, сажи. В любой каталитический реакции обязательно присутствую активные реагенты. В автомобильном катализаторе нейтрализация вредных веществ осуществляется в мелкоячеистых порах, покрытых тонким слоем редкоземельных и благородных металлов – палладий, иридий, платина. Благодаря им несгоревшие вещества принудительно и практически бесследно дожигаются.
Принцип работы
Трехкомпонентный каталитический нейтрализатор действует следующим образом:
- исходящие из цилиндров двигателя внутреннего сгорания выхлопные газы заполняют покрытые платиной и палладием ячейки, размещенные в керамических блоках;
- металлическое покрытие ячеек инициирует химическую реакцию, в результате которой происходит преобразование несгоревших углеводородов в водяной пар, а угарный газ превращается в углекислый;
- проходя через покрытые родием ячейки, оксид азота распадается на нейтральный азот и кислород;
- результат – из выхлопной трубы наружу поступают полностью очищенные от вредных компонентов газы.

Если в автомобиле установлен дизельный двигатель, то совместно с катализатором работает сажевый фильтр.
Устройство
Нейтрализатор всегда расположен после выпускного коллектора двигателя. В его состав входит:
- изготовленный из металла корпус с патрубками на входе и выходе;
- монолитный керамический блок, представляющий собой пористую структуру с многочисленными ячейками, обеспечивающими максимально большую площадь рабочей поверхности, с которой соприкасаются отработанные газы;
- каталитический слой, состоящий из редкоземельного палладия, иридия и благородной платины, а в некоторых моделях и менее дорогостоящего золота;
- теплоизоляционный металлический кожух, защищающий устройство от механических повреждений.
Катализатор предназначен для нейтрализации трех вредоносных компонентов выхлопных газов:
- ядовитых окислов азота, которые участвуют в образовании смога, провоцируют кислотные дожди;
- угарного газа, смертельно опасного для человеческого организма;
- канцерогенных углеводородов.

Виды
В современных автомобилях производители устанавливают катализаторы различных типов и модификаций. Вне зависимости от устройства и используемых для нейтрализации вредных продуктов сгорания топлива, все они более или менее в равной степени обеспечивают соответствующую европейским нормам степень очистки.
В современных автомобилях используются катализаторы:
- химические;
- металлические;
- керамические;
- магнитно-стрикционные.
Металлические
Это дорогостоящие катализаторы, в процессе производства требуют сложного технологического оборудования. В результате устройство не подвержено механическим воздействиям, колебаниям температуры. Металлическая передняя часть блока может служить нагревательным элементом. Тонкие стенки несущего материала обеспечивают невысокое аэродинамическое сопротивление, что позволяет использовать катализатор во всех разновидностях техники, в том числе повышенной мощности. Среди преимуществ – пониженный расход топлива и длительный срок эксплуатации.
Среди преимуществ – пониженный расход топлива и длительный срок эксплуатации.
Керамические катализаторы
Наиболее популярная сотовая конструкция, которая устанавливается на большинстве современных моделей автомобилей. Керамическая поверхность покрывается перечисленными выше благородными и редкоземельными металлами, которые активизируют свои каталитическое свойства под воздействием тепла. Срок службы керамического устройства в Европе не превышает 120 000 км. Это обстоятельство несколько смущает покупателей подержанных автомобилей. Но ввиду низкого качества бензина отечественного производства замену катализатора придется апроизвести после пробега максимум 80 000 км. Керамика – материал хрупкий и поэтому тряска наших дорог на ее целостности отражается самым негативным образом.
Сажевый фильтр
Если в бензиновом автомобиле используется каталитический нейтрализатор, то для очистки выхлопа дизеля устанавливается сажевый фильтр. Его задача – улавливание частиц сажи. Сажевый фильтр не имеет целью нейтрализацию вредных отходов в отработанных газах. В некоторых моделях авто производители устанавливают в сажевый фильтр дополнительные ячейки, предназначенный для улавливания содержащихся в газах вредных веществ.
Сажевый фильтр не имеет целью нейтрализацию вредных отходов в отработанных газах. В некоторых моделях авто производители устанавливают в сажевый фильтр дополнительные ячейки, предназначенный для улавливания содержащихся в газах вредных веществ.
Спортивный
Повышенная эффективность спортивного катализатора достигается за счет увеличенного слоя катализаторов. Напыления драгметаллов превосходит стандартные нейтрализаторы в 3-8 раз. В результате увеличивается его пропускная способность и срок эксплуатации. Спортивное устройство предназначено вовсе не для любителей экстремальной езды. Его можно установить и на дорогой спорткар, и на простой б/у автомобиль среднего класса.
Двухсторонние
Такие катализаторы предназначены для:
- преобразования вредного для здоровья угарного газа в нейтральный углекислый газ;
- окисления не полностью сгоревших углеводородов в воду и обычный углекислый газ.
Такие устройства нашли применение в дизельных двигателях.
Трехсторонние
Этот тип нейтрализатора решает следующие задачи:
- разложение окиси азота на составляющие – чистый азот и кислород;
- окисление угарного газа до углекислого газа;
- преобразование несгоревших продуктов в углекислый газ и воду.
Что делать, если катализатор вышел из строя
Катализатор ремонту не подлежит. Любая попытка обмануть бортовой компьютер приведет к тому, что ваш автомобиль превысит допустимые в цивилизованных странах пределы содержания вредных веществ в выхлопных газах. Цивилизованное решение – сдать вышедшую из строя деталь в утиль и установить новую, обеспечивающую безопасность для окружающих.
Скупаем все виды катализаторов — Katalizator1
Катализатор – вещество, ускоряющее химические реакции. В повседневной жизни чаще всего с ним сталкиваются автолюбители и предприятия с большим автопарком. Каталитический нейтрализатор (катализатор) — устройство для очистки выхлопных газов автомобиля. Их также применяют в химической нефтеперерабатывающей промышленности. Например, для производства бензина, смазочных масел.
Их также применяют в химической нефтеперерабатывающей промышленности. Например, для производства бензина, смазочных масел.
Почему катализатор стоит дорого
Катализаторы объединяет общее свойство – наличие в составе драгоценных металлов – платины, родия, палладия и др. Они помогают протеканию химических реакций. Главное свойство – он практически не расходуется в процессе реакции с другими веществами.
После окончания срока полезного действия в составе по-прежнему остаются драгоценные металлы, хоть и в меньшей концентрации. Это объясняет ценность автомобильных катализаторов как главного источника вторичного сырья для переработки и получения платины и палладия.
Компания Katalizator1 скупает все виды катализаторов:
- автомобильные;
- промышленные;
- для нефтепереработки.
Покупаем новые и б у в любом состоянии – целые, разбитые, в корпусе и без.
Покупаем автомобильные нейтрализаторы
Половина всех легковых автомобилей в России старше 10 лет. Их пробег к этому времени превышает 100-150 тыс. км. В наших условиях эксплуатации это предельный срок для эффективной работы нейтрализатора. Каждый автовладелец, столкнувшись с неисправностью этой детали, должен знать, что за нее он получит денежную компенсацию, сдав в специализированный пункт приема.
Их пробег к этому времени превышает 100-150 тыс. км. В наших условиях эксплуатации это предельный срок для эффективной работы нейтрализатора. Каждый автовладелец, столкнувшись с неисправностью этой детали, должен знать, что за нее он получит денежную компенсацию, сдав в специализированный пункт приема.
В зависимости от материала нейтрализаторы различаются на:
- металлические;
- керамические.
В обоих случаях активный элемент, содержащий драгметалл, наносится на ячеистую структуру, которая заключена в прочный стальной корпус. Металлические устройства стоят дороже. Они изготовлены из гофрированной фольги, их срок службы дольше, устойчивы к перепадам температур и ударам. Боятся некачественного топлива и попадания посторонних химических веществ.
Керамические сделаны их хрупкого материала, который дешевле, но боится ударов, а также ему противопоказано резкое охлаждение. Это случается при попадании воды на раскаленный корпус. При повреждении он раскалывается на части и издает характерное дребезжание при движении.
Металл чаще используют производители из Азии – Мазда, Тойота и др. Европейские производители (Мерседес, Рено, БМВ и др.) предпочитают керамику.
Купим бензиновые и дизельные катализаторы
В зависимости от двигателя устройство нейтрализатора различается. Бензиновые двигатели выделяют больше углеводородов и оксидов азота – источник смога. Дизельные загрязняют воздух сажей. Принимаем все виды устройств для очистки выхлопных газов:
- каталитические нейтрализаторы;
- сажевые фильтры;
- комбинированные нейтрализаторы.
В дизельных авто нейтрализатор дополняется сажевым фильтром, который сделан из карбида кремния и удерживает вредные частицы. Сажевый фильтр и катализатор устанавливаются друг за другом, но производятся также в виде единого комбинированного элемента (сажевый фильтр с каталитическим покрытием). Цена обычного сажевого фильтра ниже, чем нейтрализатора, однако наша компания за него также выплачивает денежную компенсацию.
Стоимость катализатора определяется оставшимся количеством драгметаллов в его составе. На это влияет срок использования. Если неисправная деталь продолжает эксплуатироваться, он не выполняет свою функцию, понижает динамику автомобиля, а оставшаяся платина и палладий расходуются впустую.
На это влияет срок использования. Если неисправная деталь продолжает эксплуатироваться, он не выполняет свою функцию, понижает динамику автомобиля, а оставшаяся платина и палладий расходуются впустую.
Что выгоднее – катализатор от иномарки или отечественного авто
Принимаем катализаторы от автомобилей независимо от страны производства. На практике в импортных автомобилях нейтрализаторы содержат больше драгметаллов, поэтому они обычно дороже даже после окончания срока службы.
Компания Katalizator1 купит все виды катализаторов по высокой цене. Мы гарантируем точную оценку содержания драгметаллов, индивидуальный подход. Предлагаем сотрудничество организациям по всей России.
Понравилась информация? Поделись с друзьями
Что такое катализатор в автомобиле — виды и принцип действия
Все автопроизводители уделяют серьезное внимание решению вопросов экологии. Фактически качество работы выхлопных систем стала второй важной проблемой после экономичности. К тому же они неразрывно связаны между собой.
Фактически качество работы выхлопных систем стала второй важной проблемой после экономичности. К тому же они неразрывно связаны между собой.
Каждый автобренд находит свои пути эффективности модернизации глушителей, катализаторов, системы в целом, агрегатов выпускаемых моделей. Актуальность процесса связана еще и с тем, что специальные организации ЕС выдвигают все новые и новые требования к транспортным средствам.
Современные типы катализаторов
Появление в новых моделях такого элемента и регулярная замена катализаторов на более эффективные — один из вариантов минимизации токсичности выхлопных газов в Санкт-Петербурге. Эти устройства призваны снижать содержание СО, СН, NO в выхлопных газах, приводя их в соответствие нормам ЕС. При увеличении содержания необходим ремонт катализатора или его замена.
Производители автомобилей применяют сегодня три типа катализаторов, с которыми могут столкнуться владельцы ТС в СПб:
- керамический,
- химический,
- магнитно-стрикционный.

Каждый из них имеет достоинства и недостатки.
Керамический катализатор
Керамический катализатор дожигания или ККД — это конструкция сотового типа, которая позволяет за счет сот увеличить площадь контакта выхлопа с поверхностью устройства. Он наиболее популярен и устанавливается в большинстве моделей в момент сборки.
Керамика при производстве изделия покрывается тонким слоем сплава с платиной, палладием, радием в своем составе. Несгоревшие остатки при соприкосновении с поверхностью каталитического слоя, окисляются кислородом. Реакция окисления активизируется под воздействием тепла. На выходе содержание вредных веществ приводится в норму.
Автовладельцы в России, которые приобретают не новые, а подержанные иномарки, не слишком любят этот тип катализатора. Срок его службы при правильной эксплуатации заканчивается примерно на 100-120 тысячах километров. Далее приходится проводить замену катализатора или ремонт катализатора в зависимости от износа и ситуации.
С учетом качества бензина на наших заправках, даже на новых машинах такие катализаторы быстро выходят из строя, поскольку некачественное топливо негативно влияет на состояние керамических сот с напылением. Они оплавляются, залипают, снижается проходимость. Машина, что называется, не тянет. Она не разгоняется, падает мощность. Это первый признак «забитости» катализатора. Срок службы его существенно сокращается. Проводить ремонт или замену катализатора приходится уже после 70-80 тысяч километров.
Также негативно сказывается на сотовом катализаторе качество российских дорог. Из-за них может потребоваться не только ремонт глушителя и других элементов, но и замена всей системы в целом.
Керамика — материал хрупкий. Он может трескаться на кочках и даже раскалываться. Отколовшиеся керамические куски сначала просто дребезжат, а затем разлетаются по выхлопной системе. Первым признаком неполадок и необходимости незамедлительного ремонта глушителей в СПБ становится не только характерное дребезжание или гул, но и то, что двигатель перестает сходу заводиться.
Химические присадки
Химический тип катализаторов — это то, что мы привычно называем присадками. В специализированных магазинах Питера их ассортимент сегодня поражает. Некоторые действительно способны улучшить некоторые эксплуатационные показатели топлива или масел. Они снижают нагрузки на узлы и агрегаты, увеличивают срок их службы.
Присадки или анамегаторы топлива меняют процесс его сгорания и его химический состав. Полнота сгорания повышается, а детонация и токсичность выхлопа снижаются. Анамегатор препятствует образованию гидропероксидов. Он ускоряет реакцию окисления молекул углеводорода, а также:
- горение происходит с высокой энергоотдачей;
- мощность двигателя увеличивается;
- расход топлива снижается;
- уменьшается нагарообразование.
Имеет химический катализатор и недостатки. Один из них — требование регулярной замены. Велик риск возникновения коррозии топливного бака и прочих агрегатов, если нарушена концентрация анамегатора. Это же может стать причиной роста расхода топлива. Вместе с тем, производители постоянно создают инновационные составы, чтобы устранить данные недостатки.
Это же может стать причиной роста расхода топлива. Вместе с тем, производители постоянно создают инновационные составы, чтобы устранить данные недостатки.
МСК или магнито-стрикционные катализаторы
Магнито-стрикционные катализаторы или МСК — наиболее современные среди прочих аналогов. Это устройства предварительной обработки топлива. Сегодня они производятся в Венгрии, Польше, КНР, Англии, России и др. Метод применяется уже более 4 десятков лет.
Суть работы МСЕ заключается в воздействии на молекулы углерода в ГСМ магнитно-стрикционным способом. Меняются при этом только физические свойства применяемого топлива.
В зависимости от того, какой тип двигателя установлен на автомобиль, применяются разные варианты установки МСК. Катализатор обеспечивает максимально возможное сгорание смеси в двигателе, за счет чего увеличивается его мощность, а также:
- снижается расход топлива,
- повышаются в 3-4 раза показатели экологичности;
- уменьшается нагароотложение на рабочих поверхностях силовых агрегатов;
- увеличивается срок их эксплуатации;
- двигатель работает бесшумно;
- детонация отсутствует;
- увеличивается пробег ТС между заменой масла.

Профессиональная установка катализаторов этого поколения занимает 5-20 минут в зависимости от типа двигателя. Прежде чем перевести автомоибль на МСК, мастер обязательно проводит диагностику всей топливной и выхлопной систем. Часто требуется корректировка зажигания на карбюраторных силовых агрегатах, регулировка винта холостых оборотов на дизелях. Инжекторные двигатели могут потребовать ремонта лямбда-зоны.
Катализаторы, ингибиторы, катализ
При попытке поджечь сахар он будет плавиться и обугливатьсяПоложите на сахар горку пепла, который будет служить катализаторомС пеплом сахар загорится! Сахар горит, если на него посыпать пеплом! При отсутствии пепла (катализатора) — сахар только обугливаетсяОкисление спирта в присутствии медного катализатора
Вы когда-нибудь пробовали поджечь сахар? Казалось бы, сильно экзотермическая реакция С12Н22О11+12О2 →12СО2+11Н2О должна идти легко. Не тут-то было — при сильном нагреве сахар плавится, приобретает коричневую окраску и запах карамели, но не загорается. И всё же сжечь сахар можно. Для этого надо посыпать его табачным пеплом и внести в пламя — тогда сахар загорится. Такое же воздействие на эту реакцию оказывают и некоторые другие вещества, например соли лития или оксид хрома (III).
Не тут-то было — при сильном нагреве сахар плавится, приобретает коричневую окраску и запах карамели, но не загорается. И всё же сжечь сахар можно. Для этого надо посыпать его табачным пеплом и внести в пламя — тогда сахар загорится. Такое же воздействие на эту реакцию оказывают и некоторые другие вещества, например соли лития или оксид хрома (III).
Химические реакции, которые «не желают» протекать сами по себе или идут с очень малой скоростью и требуют дополнительного «стимула» — присутствия веществ, которые в результате реакции остаются неизменными, — происходят повсеместно. Это, во-первых, абсолютно все химические процессы, лежащие в основе жизнедеятельности клеток. Они протекают только в присутствии ферментов, а отсутствие в организме хотя бы одного из них нарушает обмен веществ и чревато тяжёлой болезнью или же просто несовместимо с жизнью.
Кроме того, к таким реакциям относится большинство крупнотоннажных процессов, используемых в химической промышленности. Получение серной кислоты, переработка нефти, синтез аммиака немыслимы без участия «посторонних веществ», называемых катализаторами.
Как выглядел бы наш мир без катализаторов? Он был бы гораздо статичнее, ведь многие химические реакции просто не происходили бы. Впрочем, изучать химию всё равно было бы некому: жизнь в таком мире появиться не может.
Получение серной кислоты, переработка нефти, синтез аммиака немыслимы без участия «посторонних веществ», называемых катализаторами.
Как выглядел бы наш мир без катализаторов? Он был бы гораздо статичнее, ведь многие химические реакции просто не происходили бы. Впрочем, изучать химию всё равно было бы некому: жизнь в таком мире появиться не может.
Катализаторы позволяют проводить химические процессы при гораздо более мягких условиях. А кроме того, в присутствии катализаторов идут реакции, которые вообще невозможны без их участия ни в каких условиях.
При этом количество катализатора, необходимое для превращения огромной массы реагентов в продукты реакции, несоизмеримо мало. Одна молекула фермента катализирует разложение 5 млн. молекул сахара за 1 с!
Катализ и его секреты
Но в чём скрыта тайна веществ — катализаторов? Давайте разберёмся, почему сахар и другие органические вещества самопроизвольно не превращаются в углекислый газ и воду — гораздо более энергетически выгодные (говорят ещё «термодинамически устойчивые») соединения. Разве это не удивительно? Ведь если положить, скажем, шарик на вершину горки, он тут же займёт более энергетически выгодное положение — скатится вниз. Если же его оградить барьером, он скатиться не сможет. Чтобы оказаться внизу и тем самым уменьшить свою потенциальную энергию, шарику нужно преодолеть барьер, а для этого ему нужно подвести дополнительную энергию.
Разве это не удивительно? Ведь если положить, скажем, шарик на вершину горки, он тут же займёт более энергетически выгодное положение — скатится вниз. Если же его оградить барьером, он скатиться не сможет. Чтобы оказаться внизу и тем самым уменьшить свою потенциальную энергию, шарику нужно преодолеть барьер, а для этого ему нужно подвести дополнительную энергию.
Все существующие химические вещества, даже весьма термодинамически неустойчивые, окружены на своих энергетических «вершинах» подобными барьерами. Порой энергия, необходимая для их преодоления, сравнима с кинетической энергией теплового движения молекул. Тогда достаточно простого смешения реагентов — и реакция происходит при комнатной температуре. Нагревая реакционную смесь, можно преодолеть барьер чуть повыше. Но иногда он слишком высок, и в этом случае придётся или искать способы доставки необходимой энергии молекулам реагентов, или попытаться обойти энергетический барьер.
Как это сделать? Оказывается, катализатор может, подобно опытному проводнику, хорошо знающему местность, повести реакцию по совершенно иному пути. При этом её механизм претерпевает сильные изменения. Существует масса способов обойти энергетическую «гору». Каждый катализатор, работающий в конкретной реакции, выбирает для процесса свой путь. При этом новый маршрут может быть гораздо длиннее изначального: число промежуточных стадий и продуктов реакции иногда возрастает в несколько раз. Но зато количество энергии, требуемое на каждой стадии, оказывается существенно меньше, чем в отсутствие «проводника». В итоге, пройдя более длинный путь при помощи катализатора, реакция даёт желаемый результат значительно быстрее.
При этом её механизм претерпевает сильные изменения. Существует масса способов обойти энергетическую «гору». Каждый катализатор, работающий в конкретной реакции, выбирает для процесса свой путь. При этом новый маршрут может быть гораздо длиннее изначального: число промежуточных стадий и продуктов реакции иногда возрастает в несколько раз. Но зато количество энергии, требуемое на каждой стадии, оказывается существенно меньше, чем в отсутствие «проводника». В итоге, пройдя более длинный путь при помощи катализатора, реакция даёт желаемый результат значительно быстрее.
Однако «постороннее вещество» может воздействовать на ход реакции и противоположным образом: привести её к труднопреодолимому энергетическому барьеру. Тогда процесс замедляется. Такой «отрицательный» катализ называется ингибированием (от лат. inhibeo — «останавливаю», «сдерживаю»), а «катализаторы, действующие наоборот» — ингибиторами.
Зачем нужно замедлять скорость реакции? Существуют процессы, которые необходимы человеку, а также существуют такие процессы, проведение которых может пагубно сказаться как на человека, так и на предметах его обихода и окружающей среде. например появление ржавчины — коррозия металлов, гниение продуктов питания. Такими реакциями могут быть взрывы различных химических веществ, которые чувствительны к движению или сотрясению. Нужно учитывать, что химические реакции, в результате которых образуется лишь одно вещество — достаточно редкие. В основном при реакциях образуется более одного вещества. Особенно ярко такое явление наблюдается в органической химии.
например появление ржавчины — коррозия металлов, гниение продуктов питания. Такими реакциями могут быть взрывы различных химических веществ, которые чувствительны к движению или сотрясению. Нужно учитывать, что химические реакции, в результате которых образуется лишь одно вещество — достаточно редкие. В основном при реакциях образуется более одного вещества. Особенно ярко такое явление наблюдается в органической химии.
В организмах живых существ и множестве других процессах, протекающих в нашей среде обитания часто необходимо, чтобы в процессе реакции получалось только одно нужное нам вещество или продукт реакции. Именно в этом случае применяется катализ. Грамотный подбор катализатора позволяет проводить химические процессы только в нужном для нас направлении и с получением требуемого нам вещества, при этом исключая выход других побочных эффектов реакции.
В нашем организме имеются ферменты — катализаторы, которые работают точно таким же образом. Именно по аналогии с ферментами наука приобрела возможность получения каталитических реакции.
Именно по аналогии с ферментами наука приобрела возможность получения каталитических реакции.
Несмотря на аналогию и полученные знания, тайны катализа остаются полностью не раскрытыми.
Виды катализаторов
Что использовать в качестве катализатора!?
Какие виды катализаторов бывают?! В их качестве могут выступать самые разнообразные вещества: газы, ионы и различные комплексы; металлы и оксиды; простые органические соединения и сложнейшие природные и синтетические полимеры; даже… обычные вода, песок, глина!
Но самым важным фактором является агрегатное состояние катализатора и вступающих во взаимодействие веществ.
Когда катализатор, реагенты и продукты реакции находятся в одной фазе (например, жидкость, газ), где нет границ раздела, реагентам гораздо проще вступить в контакт с катализатором. При этом катализатор находится в виде молекул или ионов. Такой катализ называют гомогенным (от греч. «гомогенес» — «однородный»). В случае гетерогенного катализа (от греч. «гетерогенес» — «разнородный»), особенно если катализатор — твёрдое тело, на ход реакции воздействует не отдельная его молекула, а целый участок поверхности и подповерхностных слоёв. Это взаимодействие реагентов сразу со многими атомами или молекулами катализатора, к тому же выстроенными определённым образом, усиливает каталитическое влияние. Реакции между твёрдыми веществами всегда гетерогенны.
Такой катализ называют гомогенным (от греч. «гомогенес» — «однородный»). В случае гетерогенного катализа (от греч. «гетерогенес» — «разнородный»), особенно если катализатор — твёрдое тело, на ход реакции воздействует не отдельная его молекула, а целый участок поверхности и подповерхностных слоёв. Это взаимодействие реагентов сразу со многими атомами или молекулами катализатора, к тому же выстроенными определённым образом, усиливает каталитическое влияние. Реакции между твёрдыми веществами всегда гетерогенны.
Гомогенный катализ и гетерогенный катализ существенно различаются по своему механизму. Вероятно, с этим связана тенденция теорий катализа к «однобокости» — преимущественному объяснению либо гомогенного, либо гетерогенного катализа.
С помощью катализаторов в мире ежегодно производятся миллиарды тонн химической продукции. Около 90 % промышленных химических процессов — каталитические процессы.
Раньше всего, в начале XIX в. , обнаружили каталитические свойства благородных металлов: платины, палладия и др. До сих пор эти металлы применяются, например, в катализаторах дожигания выхлопных газов автомобилей (они переводят ядовитый угарный газ СO, образующийся при неполном окислении топлива, в углекислый газ СО2.,), при окислении аммиака NH3, в других процессах. Конечно, учёные работают над заменой дорогих металлов более дешёвыми.
, обнаружили каталитические свойства благородных металлов: платины, палладия и др. До сих пор эти металлы применяются, например, в катализаторах дожигания выхлопных газов автомобилей (они переводят ядовитый угарный газ СO, образующийся при неполном окислении топлива, в углекислый газ СО2.,), при окислении аммиака NH3, в других процессах. Конечно, учёные работают над заменой дорогих металлов более дешёвыми.
Из гомогенных каталитических реакций наиболее известны катализ кислотами и основаниями, а также солями и комплексами металлов. Самый простой кислотный катализатор — ион водорода. Он одновременно и самый маленький. В числе первых изученных каталитических реакций был гидролиз крахмала («разваливание» его на молекулы сахаров) в кислой среде. Сейчас кислотный катализ очень распространён в органической химии: ионы водорода хорошо ускоряют различные реакции спиртов, альдегидов, жирных кислот и других веществ.
Однако технологи на химических производствах больше любят гетерогенный катализ. Скажем, реакция идёт в газовой фазе, а катализатор твёрдый (пористое железо в синтезе аммиака). Так как катализатор находится в другой фазе, продукты реакции легко от него отделить. Примечательно, что тот же кислотно-основной катализ можно сделать гетерогенным: различные алюмосиликаты и оксиды металлов в зависимости от вида их обработки и состава проявляют свойства кислоты или основания
Скажем, реакция идёт в газовой фазе, а катализатор твёрдый (пористое железо в синтезе аммиака). Так как катализатор находится в другой фазе, продукты реакции легко от него отделить. Примечательно, что тот же кислотно-основной катализ можно сделать гетерогенным: различные алюмосиликаты и оксиды металлов в зависимости от вида их обработки и состава проявляют свойства кислоты или основания
Обзор различных типов катализаторов
Введение
В современную научную эпоху катализ занимает важное место как в академических исследованиях, так и в промышленности со значительным потенциалом применения в повседневной жизни, включая химические продукты тонкой очистки, агрохимикаты (синтез пестицидов, удобрений), фармацевтические препараты, нефть (в нефтепереработке, производстве биотоплива, топливные элементы и т. д.), полимеры (пластмассы, клеи), электроника и очистка окружающей среды (ограничение выбросов вредных газов из автомобилей и стационарных источников, удаление CO и запахов из воздуха в помещении и очистка грунтовых вод). Согласно недавно опубликованному отчету «Рынок катализаторов — размер, доля, рост, тенденции и прогноз в мировой отрасли на 2012–2018 годы», мировая рыночная стоимость катализаторов в 2014 году составляла 19,2 млрд долларов США в год и, как ожидается, достигнет 24,1 млрд долларов США к 2018. Технология использования катализаторов хорошо известна с древних времен, хотя концепция катализа в то время не была ясна. Это включает образование спирта из сахара путем ферментации, синтез мыла путем гидролиза животного жира с использованием едкого калия, превращение спирта в эфир, катализируемое серной кислотой.В 1836 году термин «катализ» был придуман шведским химиком Берциллиусом, а Оствальд в 1895 году научно объяснил его следующим образом: «катализатор ускоряет химическую реакцию, не влияя на положение равновесия». В 1909 году Оствальд был награжден благородной премией за новаторскую работу в этой области.
Согласно недавно опубликованному отчету «Рынок катализаторов — размер, доля, рост, тенденции и прогноз в мировой отрасли на 2012–2018 годы», мировая рыночная стоимость катализаторов в 2014 году составляла 19,2 млрд долларов США в год и, как ожидается, достигнет 24,1 млрд долларов США к 2018. Технология использования катализаторов хорошо известна с древних времен, хотя концепция катализа в то время не была ясна. Это включает образование спирта из сахара путем ферментации, синтез мыла путем гидролиза животного жира с использованием едкого калия, превращение спирта в эфир, катализируемое серной кислотой.В 1836 году термин «катализ» был придуман шведским химиком Берциллиусом, а Оствальд в 1895 году научно объяснил его следующим образом: «катализатор ускоряет химическую реакцию, не влияя на положение равновесия». В 1909 году Оствальд был награжден благородной премией за новаторскую работу в этой области.
Типы катализаторов
Катализаторы в основном делятся на четыре типа. Это (1) гомогенный, (2) гетерогенный (твердый), (3) гетерогенный гомогенный катализатор и (4) биокатализаторы.
Это (1) гомогенный, (2) гетерогенный (твердый), (3) гетерогенный гомогенный катализатор и (4) биокатализаторы.
1) Гомогенный катализатор: При гомогенном катализе реакционная смесь и катализатор находятся в одной и той же фазе. И катализатор, и реагенты демонстрируют высокую гомогенность, что приводит к сильному взаимодействию между ними, что приводит к высокой реакционной способности и селективности реакции в мягких условиях реакции. Некоторыми примерами гомогенных катализаторов являются кислоты Бренстеда и Льюиса, переходные металлы, металлоорганические комплексы, органокатализаторы. Некоторые известные химические процессы, которые происходят посредством гомогенного катализа, включают карбонилирование, окисление, гидроцианирование, метатезис и гидрирование.
2) Гетерогенный катализатор: При гетерогенном катализе катализаторы существуют в другой фазе, чем реакционная смесь. Некоторые из типичных процессов, в которых используются гетерогенные катализаторы, — это процесс Хабера-Боша для синтеза аммиака, процесс Фишера-Тропша для получения различных углеводородов. Гетерогенные катализаторы преобладают в основных промышленных процессах из-за легкого отделения продукта и извлечения катализатора. Гетерогенные катализаторы могут использоваться в виде мелких частиц, порошков, гранул.Эти катализаторы могут быть нанесены на твердый носитель (катализаторы на носителе) или использоваться в объемной форме (катализаторы без носителя).
Гетерогенные катализаторы преобладают в основных промышленных процессах из-за легкого отделения продукта и извлечения катализатора. Гетерогенные катализаторы могут использоваться в виде мелких частиц, порошков, гранул.Эти катализаторы могут быть нанесены на твердый носитель (катализаторы на носителе) или использоваться в объемной форме (катализаторы без носителя).
Поддерживаемые катализаторы играют ключевую роль в промышленной революции. Поскольку гетерогенный катализ является поверхностным явлением, эффективность катализаторов зависит от открытой площади поверхности. Открытая площадь поверхности увеличивается с уменьшением размера частиц, но более мелкие частицы имеют тенденцию к агрегированию, что приводит к дезактивации катализатора. Привязка каталитического активного центра к твердой подложке предотвращает агломерацию каталитических частиц, тем самым улучшая каталитические характеристики.Считается, что для промышленного применения твердые подложки обладают высокой химической, механической и термической стабильностью. Кроме того, он должен быть инертным и иметь высокое соотношение поверхности к объему. Обычно используемые твердые органические носители могут быть полимерами (например, полистиролом), сополимерами (например, стирол-дивинилбензол) и неорганическими носителями, такими как диоксид кремния, цеолиты, оксид алюминия, активированный уголь, диоксид титана, графен.
Кроме того, он должен быть инертным и иметь высокое соотношение поверхности к объему. Обычно используемые твердые органические носители могут быть полимерами (например, полистиролом), сополимерами (например, стирол-дивинилбензол) и неорганическими носителями, такими как диоксид кремния, цеолиты, оксид алюминия, активированный уголь, диоксид титана, графен.
Катализаторы без подложки занимают большую часть промышленного катализа. Сюда входят металлы, металлические сплавы, оксиды металлов, сульфиды металлов, цеолиты и т. Д.
3) Гетерогенные гомогенные катализаторы : Гетерогенные катализаторы, в отличие от их гомогенных аналогов, намного сложнее разработать на практике. Одна из причин — их сложность, которая препятствует их анализу на молекулярном уровне и развитию через взаимосвязи структура – реакционная способность. Кроме того, традиционные гетерогенные катализаторы (оксиды металлов или металлы на носителе) обладают меньшей селективностью и реакционной способностью. Чтобы преодолеть эти проблемы, гомогенный катализатор прививают на твердые носители для получения их гетерогенных аналогов.В настоящее время гомогенные катализаторы на твердой основе широко признаны и широко используются в научных и промышленных исследованиях. Цель этого подхода состоит в том, чтобы перекрыть положительные характеристики как гомогенного (селективность и реакционная способность), так и гетерогенного катализатора (воспроизводимость), и это может быть достигнуто за счет иммобилизации катализаторов, таких как комплексы металлов, металлоорганические соединения, на твердой поверхности посредством физической адсорбции или хемосорбция. Ковалентная прививка каталитически активных частиц на твердые поверхности оказывается наиболее предпочтительным подходом для создания гетерогенного гомогенного катализатора.
Чтобы преодолеть эти проблемы, гомогенный катализатор прививают на твердые носители для получения их гетерогенных аналогов.В настоящее время гомогенные катализаторы на твердой основе широко признаны и широко используются в научных и промышленных исследованиях. Цель этого подхода состоит в том, чтобы перекрыть положительные характеристики как гомогенного (селективность и реакционная способность), так и гетерогенного катализатора (воспроизводимость), и это может быть достигнуто за счет иммобилизации катализаторов, таких как комплексы металлов, металлоорганические соединения, на твердой поверхности посредством физической адсорбции или хемосорбция. Ковалентная прививка каталитически активных частиц на твердые поверхности оказывается наиболее предпочтительным подходом для создания гетерогенного гомогенного катализатора.
4) Биокатализаторы: Природные белки (ферменты) или нуклеиновые кислоты (РНК или рибозимы и ДНК), используемые для катализирования конкретных химических реакций вне живых клеток, называются биокатализом. Ферменты получают из тканей животных, растений и микробов (дрожжей, бактерий или грибов). Высокая селективность, высокая эффективность, экологичность и мягкие условия реакции являются движущими силами для их крупномасштабного использования и делают биокатализаторы альтернативой обычным промышленным катализаторам.Значительный прогресс в области белковой инженерии и молекулярной эволюции произвел революцию в мире биокатализа для синтеза в промышленных масштабах химических веществ тонкой очистки, биотоплива с активными ингредиентами (АФИ) (например, липазы для производства биодизельного топлива из растительного масла), молочной промышленности (например, протеазы). , липаза для удаления лактозы, ренин для приготовления сыра), хлебопекарная промышленность (например, амилаза для мягкости и объема хлеба, оксидаза глюкозы для укрепления теста), производство моющих средств (например,грамм. протеиназа, липаза, амилаза, используемые для удаления пятен белков, жиров, крахмала, соответственно), кожевенная промышленность (например, протеаза для расчесывания волос), бумажная промышленность, текстильная промышленность (например, амилаза для удаления крахмала с тканых тканей).
Ферменты получают из тканей животных, растений и микробов (дрожжей, бактерий или грибов). Высокая селективность, высокая эффективность, экологичность и мягкие условия реакции являются движущими силами для их крупномасштабного использования и делают биокатализаторы альтернативой обычным промышленным катализаторам.Значительный прогресс в области белковой инженерии и молекулярной эволюции произвел революцию в мире биокатализа для синтеза в промышленных масштабах химических веществ тонкой очистки, биотоплива с активными ингредиентами (АФИ) (например, липазы для производства биодизельного топлива из растительного масла), молочной промышленности (например, протеазы). , липаза для удаления лактозы, ренин для приготовления сыра), хлебопекарная промышленность (например, амилаза для мягкости и объема хлеба, оксидаза глюкозы для укрепления теста), производство моющих средств (например,грамм. протеиназа, липаза, амилаза, используемые для удаления пятен белков, жиров, крахмала, соответственно), кожевенная промышленность (например, протеаза для расчесывания волос), бумажная промышленность, текстильная промышленность (например, амилаза для удаления крахмала с тканых тканей). Иммобилизация ферментов на твердых носителях превращает ферменты в гетерогенный твердый катализатор, который повышает активность, стабильность и увеличивает срок службы катализатора, который можно повторно использовать в течение многих циклов.
Иммобилизация ферментов на твердых носителях превращает ферменты в гетерогенный твердый катализатор, который повышает активность, стабильность и увеличивает срок службы катализатора, который можно повторно использовать в течение многих циклов.
Таблица 1: Сравнение различных типов катализаторов
Будущий аспект катализа
В последние годы в области катализа были достигнуты значительные успехи.С постоянно растущим спросом на невозобновляемые природные ресурсы, чистый воздух, химические вещества и фармацевтические препараты, катализаторы будут оставаться в авангарде химических исследований и разработок. Катализаторы позволили нам синтезировать сложные молекулы за меньшее количество этапов, а также были успешно использованы на нефтеперерабатывающих заводах для производства топлива с низким содержанием серы. Катализаторы также сыграли важную роль в снижении выбросов CO, NOx, несгоревших углеводородов от транспортных средств, работающих на бензине, дизельном и реактивном топливе. Тем не менее, существует множество проблем, связанных с широко используемыми каталитическими системами, включая стоимость, доступность, токсичность многих драгоценных металлов, используемых в качестве катализаторов, и необходимость в дорогих и сложных лигандах для достижения желаемых превращений. Ученые и химики сосредотачиваются на разработке катализаторов с высокой селективностью, реакционной способностью, стабильностью, низкой загрузкой катализатора с большим числом оборотов. Последние разработки в области нанотехнологий открывают новые возможности для разработки и синтеза наноструктурированных катализаторов с большой площадью поверхности и открытыми активными центрами, что в конечном итоге приводит к высокой каталитической активности.Концепция комбинирования органокатализаторов и катализаторов на основе переходных металлов недавно привлекла внимание в связи с ее использованием в органическом синтезе, где металлическая часть обеспечивает высокую активность, а часть органокатализатора обеспечивает высокую селективность.
Тем не менее, существует множество проблем, связанных с широко используемыми каталитическими системами, включая стоимость, доступность, токсичность многих драгоценных металлов, используемых в качестве катализаторов, и необходимость в дорогих и сложных лигандах для достижения желаемых превращений. Ученые и химики сосредотачиваются на разработке катализаторов с высокой селективностью, реакционной способностью, стабильностью, низкой загрузкой катализатора с большим числом оборотов. Последние разработки в области нанотехнологий открывают новые возможности для разработки и синтеза наноструктурированных катализаторов с большой площадью поверхности и открытыми активными центрами, что в конечном итоге приводит к высокой каталитической активности.Концепция комбинирования органокатализаторов и катализаторов на основе переходных металлов недавно привлекла внимание в связи с ее использованием в органическом синтезе, где металлическая часть обеспечивает высокую активность, а часть органокатализатора обеспечивает высокую селективность. Хотя с помощью металлоорганокатализа были успешно выполнены различные органические превращения, которые нельзя было осуществить с использованием одного только катализатора. Еще остается много места, начиная от тонкого проектирования и комбинирования основных строительных блоков и, наконец, для демонстрации их применения в различных областях катализа.
Хотя с помощью металлоорганокатализа были успешно выполнены различные органические превращения, которые нельзя было осуществить с использованием одного только катализатора. Еще остается много места, начиная от тонкого проектирования и комбинирования основных строительных блоков и, наконец, для демонстрации их применения в различных областях катализа.
1. Введение в типы катализаторов
На этой странице рассматриваются различные типы катализаторов (гетерогенные и гомогенные) с примерами каждого типа и объяснениями того, как они работают. Вы также найдете описание одного примера автокатализа — реакции, которая катализируется одним из его продуктов.
Типы каталитических реакций
Катализаторыможно разделить на два основных типа — гетерогенные и гомогенные. В гетерогенной реакции катализатор находится в фазе, отличной от фазы реагентов.В гомогенной реакции катализатор находится в той же фазе, что и реагенты.
Что такое фаза? Если вы посмотрите на смесь и увидите границу между двумя компонентами, эти вещества находятся в разных фазах. Смесь, содержащая твердое вещество и жидкость, состоит из двух фаз. Смесь различных химикатов в одном растворе состоит только из одной фазы, потому что между ними не видно границы.
Смесь, содержащая твердое вещество и жидкость, состоит из двух фаз. Смесь различных химикатов в одном растворе состоит только из одной фазы, потому что между ними не видно границы.
Вы можете спросить, почему фаза отличается от термина «физическое состояние» (твердое, жидкое или газообразное).Он включает твердые вещества, жидкости и газы, но на самом деле является более общим. Это также может относиться к двум жидкостям (например, маслу и воде), которые не растворяются друг в друге. Вы могли видеть границу между двумя жидкостями.
Если вы хотите быть внимательным к вещам, диаграммы на самом деле показывают больше фаз, чем указано. Каждый, например, также имеет стеклянный стакан в качестве твердой фазы. У всех наверняка есть газ над жидкостью — это еще одна фаза. Мы не учитываем эти дополнительные фазы, потому что они не являются частью реакции.
Гетерогенный катализ
Это включает использование катализатора в фазе, отличной от фазы реагентов. Типичные примеры включают твердый катализатор с реагентами в виде жидкостей или газов. Большинство примеров гетерогенного катализа проходят одни и те же стадии:
Типичные примеры включают твердый катализатор с реагентами в виде жидкостей или газов. Большинство примеров гетерогенного катализа проходят одни и те же стадии:
Один или несколько реагентов адсорбируются на поверхности катализатора в активных центрах.
Существует какое-то взаимодействие между поверхностью катализатора и молекулами реагента, которое делает их более активными.
Реакция происходит.
Молекулы продукта десорбируются.
Адсорбция — это когда что-то прилипает к поверхности. Это не то же самое, что поглощение, когда одно вещество поглощается структурой другого. Будь осторожен!
Активный сайт — это часть поверхности, которая особенно хорошо адсорбирует предметы и помогает им реагировать.
Это может быть фактическая реакция с поверхностью или некоторое ослабление связей в прикрепленных молекулах.
На этой стадии обе молекулы реагента могут быть прикреплены к поверхности, или одна может быть прикреплена и поражена другой, свободно движущейся в газе или жидкости.

Десорбция означает просто отрыв молекул продукта. Это оставляет активный сайт доступным для нового набора молекул, с которым он может присоединиться и вступить в реакцию.
Хороший катализатор должен адсорбировать молекулы реагента достаточно сильно, чтобы они вступили в реакцию, но не настолько сильно, чтобы молекулы продукта более или менее постоянно прилипали к поверхности.
Серебро, например, не является хорошим катализатором, потому что оно не образует достаточно прочных связей с молекулами реагентов. С другой стороны, вольфрам не является хорошим катализатором, потому что он слишком сильно адсорбируется.
Металлы, такие как платина и никель, являются хорошими катализаторами, потому что они адсорбируются достаточно сильно, чтобы удерживать и активировать реагенты, но не настолько сильно, чтобы продукты не могли оторваться.
Примеры гетерогенного катализа
Гидрирование двойной углерод-углеродной связи
Простейшим примером этого является реакция этена с водородом в присутствии никелевого катализатора.
На практике это бессмысленная реакция, потому что вы превращаете чрезвычайно полезный этен в относительно бесполезный этан. Однако такая же реакция будет происходить с любым соединением, содержащим двойную связь углерод-углерод.
Одним из важных промышленных применений является гидрирование растительных масел для производства маргарина, которое также включает реакцию двойной углерод-углеродной связи в растительном масле с водородом в присутствии никелевого катализатора.
Молекулы этена адсорбируются на поверхности никеля. Двойная связь между атомами углерода разрывается, и электроны связывают ее с поверхностью никеля.
Молекулы водорода также адсорбируются на поверхности никеля. Когда это происходит, молекулы водорода распадаются на атомы. Они могут перемещаться по поверхности никеля.
Если атом водорода диффундирует рядом с одним из связанных атомов углерода, связь между углеродом и никелем заменяется на связь между углеродом и водородом.
Этот конец исходного этена теперь отрывается от поверхности, и в конечном итоге то же самое произойдет на другом конце.
Как и раньше, один из атомов водорода образует связь с углеродом, и этот конец также разрывается. Теперь на поверхности никеля есть место для новых молекул реагентов, которые снова смогут пройти весь процесс.
Каталитические нейтрализаторы
Каталитические нейтрализаторы превращают ядовитые молекулы, такие как окись углерода и различные окиси азота в выхлопных газах автомобилей, в более безвредные молекулы, такие как углекислый газ и азот.В качестве гетерогенного катализатора они используют дорогие металлы, такие как платина, палладий и родий.
Металлы наносятся тонкими слоями на керамические соты. Это увеличивает площадь поверхности и сводит к минимуму количество используемого металла.
Принимая реакцию между оксидом углерода и оксидом азота за типичную:
Каталитические нейтрализаторы могут быть повреждены отравлением катализатора. Это происходит, когда что-то, что не является частью реакции, очень сильно адсорбируется на поверхности катализатора, не позволяя нормальным реагентам достичь его.
Это происходит, когда что-то, что не является частью реакции, очень сильно адсорбируется на поверхности катализатора, не позволяя нормальным реагентам достичь его.
Свинец — привычный каталитический яд для каталитических нейтрализаторов. Он покрывает соты из дорогих металлов и останавливает их работу.
Раньше в бензин (бензин) добавляли соединения свинца для более плавного горения в двигателе. Но вы не можете использовать каталитический нейтрализатор, если используете этилированное топливо. Таким образом, каталитические нейтрализаторы не только помогли удалить ядовитые газы, такие как окись углерода и оксиды азота, но также способствовали удалению ядовитых соединений свинца из бензина.
Использование оксида ванадия (V) в контактном процессе
Во время контактного процесса производства серной кислоты диоксид серы должен быть преобразован в триоксид серы. Это достигается пропусканием диоксида серы и кислорода над твердым катализатором на основе оксида ванадия (V).
Этот пример немного отличается от предыдущих, потому что газы фактически реагируют с поверхностью катализатора, временно изменяя ее. Это хороший пример способности переходных металлов и их соединений действовать как катализаторы из-за их способности изменять степень окисления.
Диоксид серы окисляется оксидом ванадия (V) до триоксида серы. В процессе оксид ванадия (V) восстанавливается до оксида ванадия (IV).
Затем оксид ванадия (IV) повторно окисляется кислородом.
Это хороший пример того, как катализатор может быть изменен в ходе реакции. Однако в конце реакции химический состав будет таким же, как и начался.
Гомогенный катализ
Катализатор находится в той же фазе, что и реагенты.Обычно все присутствует в виде газа или содержится в одной жидкой фазе. Примеры содержат по одному из них. . .
Примеры гомогенного катализа
Реакция между персульфат-ионами и иодид-ионами
Это реакция раствора, которую вы можете встретить только в контексте катализа, но это прекрасный пример!
Персульфат-ионы (пероксодисульфат-ионы), S 2 O 8 2- , являются очень сильными окислителями. Иодид-ионы очень легко окисляются до йода. И все же реакция между ними в растворе в воде очень медленная.
Иодид-ионы очень легко окисляются до йода. И все же реакция между ними в растворе в воде очень медленная.
Если вы посмотрите на уравнение, легко понять, почему это так:
Для реакции требуется столкновение двух отрицательных ионов. Этому серьезно помешает отталкивание!
Катализированная реакция полностью устраняет эту проблему. Катализатором могут быть ионы железа (II) или железа (III), которые добавляются в один и тот же раствор.Это еще один хороший пример использования соединений переходных металлов в качестве катализаторов из-за их способности изменять степень окисления.
Для аргументации в качестве катализатора примем ионы железа (II). Как вы вскоре увидите, на самом деле не имеет значения, используете ли вы ионы железа (II) или железа (III).
Ионы персульфата окисляют ионы железа (II) до ионов железа (III). В процессе ионы персульфата восстанавливаются до ионов сульфата.
Ионы железа (III) являются достаточно сильными окислителями, чтобы окислять иодид-ионы до йода. В процессе они снова восстанавливаются до ионов железа (II).
В процессе они снова восстанавливаются до ионов железа (II).
Обе эти отдельные стадии в общей реакции включают столкновение между положительными и отрицательными ионами. Это будет гораздо более успешным, чем столкновение двух отрицательных ионов в некаталитической реакции.
Что произойдет, если в качестве катализатора использовать ионы железа (III) вместо ионов железа (II)? Просто реакции происходят в другом порядке.
Разрушение атмосферного озона
Это хороший пример гомогенного катализа, где все присутствует в виде газа.
Озон, O 3 , постоянно образуется и снова распадается в высоких слоях атмосферы под действием ультрафиолетового света. Обычные молекулы кислорода поглощают ультрафиолетовый свет и распадаются на отдельные атомы кислорода. Они имеют неспаренные электроны и известны как свободные радикалы. Они очень реактивны.
Кислородные радикалы могут затем соединяться с обычными молекулами кислорода с образованием озона.
Озон также можно снова разделить на обычный кислород и кислородный радикал, поглощая ультрафиолетовый свет.
Это образование и распад озона происходит постоянно. Взятые вместе, эти реакции останавливают большое количество вредного ультрафиолетового излучения, проникающего в атмосферу и достигающего поверхности Земли.
Каталитическая реакция, в которой мы заинтересованы, разрушает озон и, таким образом, останавливает поглощение им ультрафиолета.
Хлорфторуглероды (CFC), такие как CF 2 Cl 2 , например, широко использовались в аэрозолях и в качестве хладагентов.При их медленном распаде в атмосфере образуются атомы хлора — свободные радикалы хлора. Они катализируют разрушение озона.
Это происходит в два этапа. В первом случае озон расщепляется и образуется новый свободный радикал.
Катализатор на основе хлор-радикала регенерируется второй реакцией. Это может происходить двумя способами в зависимости от того, попадает ли радикал ClO в молекулу озона или радикал кислорода.
Если он попадает в кислородный радикал (образованный в результате одной из реакций, которые мы рассмотрели ранее):
Или, если он попадает в молекулу озона:
Поскольку радикал хлора продолжает регенерироваться, каждый из них может разрушить тысячи молекул озона.
Автокатализ
Окисление этандиовой кислоты ионами манганата (VII)
При автокатализе реакция катализируется одним из его продуктов. Один из простейших примеров этого — окисление раствора этандиовой кислоты (щавелевой кислоты) подкисленным раствором манганата калия (VII) (перманганат калия).
Реакция очень медленная при комнатной температуре. Он используется в качестве титрования для определения концентрации раствора манганата калия (VII) и обычно проводится при температуре около 60 ° C.Тем не менее, это довольно медленно для начала.
Реакция катализируется ионами марганца (II). Очевидно, что до начала реакции никого из них нет, и поэтому она начинается очень медленно при комнатной температуре. Однако, если вы посмотрите на уравнение, вы обнаружите ионы марганца (II) среди продуктов. По мере протекания реакции образуется все больше и больше катализатора, поэтому реакция ускоряется.
Очевидно, что до начала реакции никого из них нет, и поэтому она начинается очень медленно при комнатной температуре. Однако, если вы посмотрите на уравнение, вы обнаружите ионы марганца (II) среди продуктов. По мере протекания реакции образуется все больше и больше катализатора, поэтому реакция ускоряется.
Вы можете измерить этот эффект, построив график концентрации одного из реагентов с течением времени.Вы получите график, совершенно не похожий на кривую нормальной скорости реакции.
Большинство реакций дают кривую скорости, которая выглядит следующим образом:
Концентрации высоки вначале, поэтому реакция протекает быстро, о чем свидетельствует быстрое падение концентрации реагента. По мере того, как вещи израсходуются, реакция замедляется и в конечном итоге останавливается, когда один или несколько реагентов полностью израсходованы.
Пример автокатализа дает такую кривую:
Вначале вы видите медленную (некаталитическую) реакцию. Когда в смеси начинает образовываться катализатор, реакция ускоряется, становясь все быстрее и быстрее по мере того, как образуется все больше и больше катализатора. В конце концов, конечно, по мере того, как вещи истощаются, ставка снова падает.
Когда в смеси начинает образовываться катализатор, реакция ускоряется, становясь все быстрее и быстрее по мере того, как образуется все больше и больше катализатора. В конце концов, конечно, по мере того, как вещи истощаются, ставка снова падает.
Внимание!
Не думайте, что кривая скорости, которая выглядит так, обязательно показывает пример автокатализа. Есть и другие эффекты, которые могут дать аналогичный график.
Например, если реакция включает реакцию твердого вещества с жидкостью, на твердом теле может быть какой-то поверхностный слой, через который жидкость должна проникнуть, прежде чем может произойти ожидаемая реакция.
Более распространенная возможность — это сильно экзотермическая реакция и неправильный контроль температуры. Тепло, выделяющееся во время реакции, ускоряет реакцию.
различных типов катализаторов | Sciencing
Обновлено 1 декабря 2018 г.
Автор: Кевин Бек
В химии катализатор — это вещество, которое ускоряет скорость реакции, но при этом не расходуется на нее. Любая реакция, в которой используется катализатор, называется катализом .Будьте осторожны с этим различием при чтении материалов по химии; катализатор (во множественном числе «катализаторы») — это физическое вещество, но катализ (во множественном числе «катализаторы») — это процесс.
Любая реакция, в которой используется катализатор, называется катализом .Будьте осторожны с этим различием при чтении материалов по химии; катализатор (во множественном числе «катализаторы») — это физическое вещество, но катализ (во множественном числе «катализаторы») — это процесс.
Обзор каждого из классов катализаторов — полезная отправная точка в изучении аналитической химии и понимании того, что происходит на молекулярном уровне, когда вы смешиваете вещества вместе и происходит реакция. Катализаторы и связанные с ними каталитические реакции бывают трех основных типов: гомогенные катализаторы, гетерогенные катализаторы и биокатализаторы (обычно называемые ферментами).Менее распространенные, но все же важные виды активности катализаторов включают фотокатализ, экологический катализ и экологические каталитические процессы.
Общие характеристики катализаторов
Большинство твердых катализаторов представляют собой металлы (например, платина или никель) или почти металлы (например, кремний, бор и алюминий), присоединенные к таким элементам, как кислород и сера. Катализаторы, которые находятся в жидкой или газовой фазе, с большей вероятностью будут состоять из одного элемента, хотя они могут быть объединены с растворителями и другими материалами, а твердые катализаторы могут быть распределены в твердой или жидкой матрице, известной как носитель катализатора.
Катализаторы, которые находятся в жидкой или газовой фазе, с большей вероятностью будут состоять из одного элемента, хотя они могут быть объединены с растворителями и другими материалами, а твердые катализаторы могут быть распределены в твердой или жидкой матрице, известной как носитель катализатора.
Катализаторы ускоряют реакции за счет снижения энергии активации E реакции, которая протекает без катализатора, но намного медленнее. В таких реакциях есть продукт или продукты с более низкой общей энергией, чем у реагента или реагентов; если бы это было не так, эти реакции не могли бы происходить без добавления внешней энергии. Но чтобы перейти из состояния с более высокой энергией в состояние с более низкой энергией, продукты должны сначала «преодолеть горб», которым является E a .Катализаторы, по сути, сглаживают неровности на пути энергии реакции, облегчая реагентам переход на энергетический «нисходящий наклон» реакции, просто понижая высоту «вершины холма».
Химические системы содержат примеры положительных и отрицательных катализаторов, причем первые имеют тенденцию ускорять скорость реакции, а отрицательные катализаторы служат для их замедления. Оба могут быть полезными в зависимости от желаемого конкретного результата.
Химический состав катализатора
Катализаторы выполняют свою работу путем временного связывания или иного химического изменения одного из реагентов и изменения его физической конформации или трехмерной формы таким образом, чтобы облегчить преобразование реагента или реагентов. в один из продуктов.Представьте себе собаку, которая валяется в грязи, и ее нужно очистить, прежде чем она сможет войти внутрь. Грязь со временем сошла бы с собаки сама по себе, но если бы вы могли сделать что-то, что толкнуло собаку в направлении разбрызгивателя двора так, чтобы грязь быстро смылась с ее шерсти, вы, по сути, послужили бы «катализатором» «реакция грязной собаки на чистую собаку».
Чаще всего промежуточный продукт, не показанный в обычном обзоре реакции, образуется из реагента и катализатора, и когда этот комплекс превращается в один или несколько конечных продуктов, катализатор регенерируется, как будто ничего никогда не происходило. вообще ничего из этого.Как вы вскоре увидите, этот процесс может происходить разными способами.
Гомогенный катализ
Реакция считается гомогенно катализируемой , когда катализатор и реагент (ы) находятся в одном физическом состоянии или фазе. Чаще всего это происходит с парами газообразный катализатор-реагент. Типы гомогенных катализаторов включают органические кислоты, в которых переданный атом водорода заменен на металл, ряд соединений, в которых в той или иной форме сочетаются углерод и металлические элементы, а также карбонильные соединения, соединенные с кобальтом или железом.
Примером этого типа катализа с участием жидкостей является превращение персульфат- и йодид-ионов в сульфат-ион и йод:
S 2 O 8 2- + 2 I — → 2 SO 4 2- + I 2
Этой реакции было бы трудно протекать самостоятельно, несмотря на благоприятную энергетику, потому что оба реагента имеют отрицательный заряд и, следовательно, их электростатические свойства противоречат их химическим свойствам. Но если в смесь добавляются ионы железа, несущие положительный заряд, железо «отвлекает» отрицательные заряды, и реакция быстро идет вперед.
Но если в смесь добавляются ионы железа, несущие положительный заряд, железо «отвлекает» отрицательные заряды, и реакция быстро идет вперед.
Природный газообразный гомогенный катализ — это превращение газообразного кислорода, или O 2 , в атмосфере в озон, или O 3 , где кислородные радикалы (O — ) являются промежуточными продуктами. Здесь ультрафиолетовый свет солнца является настоящим катализатором, но все присутствующие физические соединения находятся в одном и том же (газовом) состоянии.
Гетерогенный катализ
Реакция считается гетерогенно катализируемой , когда катализатор и реагент (ы) находятся в разных фазах, причем реакция происходит на границе раздела между ними (чаще всего, на границе газ-твердое тело). Некоторые из наиболее распространенных гетерогенных катализаторов включают неорганические, то есть не содержащие углерод, твердые вещества, такие как элементарные металлы, сульфиды и соли металлов, а также небольшое количество органических веществ, среди которых гидропероксиды и ионообменники.
Цеолиты — важный класс гетерогенных катализаторов. Это твердые кристаллические вещества, состоящие из повторяющихся звеньев SiO 4 . Единицы четырех из этих соединенных молекул связаны вместе, образуя различные кольцевые и каркасные структуры. Присутствие атома алюминия в кристалле создает дисбаланс заряда, который компенсируется протоном (то есть ионом водорода).
Ферменты
Ферменты — это белки, которые действуют как катализаторы в живых системах. Эти ферменты имеют компоненты, называемые сайтами связывания субстрата или активными сайтами, где молекулы, участвующие в реакции при катализе, присоединяются.Составными частями всех белков являются аминокислоты, и каждая из этих отдельных кислот имеет неравномерное распределение заряда от одного конца к другому. Это свойство является основной причиной того, что ферменты обладают каталитическими способностями.
Активный центр фермента совпадает с правильной частью субстрата (реагента), как ключ, входящий в замок. Обратите внимание, что катализаторы, описанные ранее, часто катализируют множество разнородных реакций и поэтому не обладают такой степенью химической специфичности, как ферменты.
Обратите внимание, что катализаторы, описанные ранее, часто катализируют множество разнородных реакций и поэтому не обладают такой степенью химической специфичности, как ферменты.
Обычно, когда присутствует больше субстрата и больше фермента, реакция протекает быстрее. Но если добавляется все больше и больше субстрата без добавления фермента, все участки связывания ферментов становятся насыщенными, и реакция достигает максимальной скорости для этой концентрации фермента. Каждую реакцию, катализируемую ферментом, можно представить в виде промежуточных продуктов, образующихся благодаря присутствию фермента. То есть вместо того, чтобы писать:
, чтобы показать, что субстрат трансформируется в продукт, вы можете изобразить это как:
, где средний термин представляет собой комплекс фермент-субстрат (ES).
Ферменты, хотя и классифицируются как категория катализаторов, отличная от перечисленных выше, могут быть гомогенными или гетерогенными.
Ферменты оптимально функционируют в узком температурном диапазоне, что имеет смысл, учитывая, что температура вашего тела не колеблется более чем на несколько градусов в обычных условиях. Сильная жара разрушает многие ферменты и заставляет их терять свою трехмерную форму, процесс, называемый денатурацией, применим ко всем белкам.
Сильная жара разрушает многие ферменты и заставляет их терять свою трехмерную форму, процесс, называемый денатурацией, применим ко всем белкам.
Катализ | Безграничная химия
Гетерогенный катализ
Гетерогенный катализ — это тип катализа, при котором катализатор занимает фазу, отличную от фазы реакционной смеси.
Цели обучения
Катализаторы классифицируются как гетерогенные или гомогенные
Основные выводы
Ключевые моменты
- Катализаторы можно разделить на гомогенные и гетерогенные катализаторы, в зависимости от того, находятся ли они в той же фазе, что и реакционная смесь.
- В общем, гетерогенные катализаторы представляют собой твердые вещества, которые добавляют в газовые или жидкие реакционные смеси.
- При гетерогенном катализе реагенты адсорбируются на связывающих центрах на поверхности катализатора, и доступность этих реакционных центров может ограничивать скорость гетерогенных реакций.

Ключевые термины
- катализатор : Вещество, которое увеличивает скорость химической реакции, но не расходуется в процессе.
Катализаторы — это химические соединения, которые увеличивают скорость реакции за счет снижения энергии активации, необходимой для достижения переходного состояния.В отличие от реагентов, катализатор в процессе реакции не расходуется. Процесс ускорения реакции с использованием катализатора известен как катализ .
Типы катализаторов
Адсорбция этена на твердой поверхности катализатора : Катализатор выравнивает молекулу этена с водородом, позволяя им реагировать более эффективно, чем если бы они были просто объединены в контейнере и случайно сталкивались.
Катализаторы можно разделить на два типа: гомогенные и гетерогенные, в зависимости от фазы реакции, которую они занимают.Гомогенные катализаторы — это катализаторы, которые находятся в той же фазе, что и реакционная смесь (обычно жидкость или газ), в то время как гетерогенные катализаторы занимают другую фазу.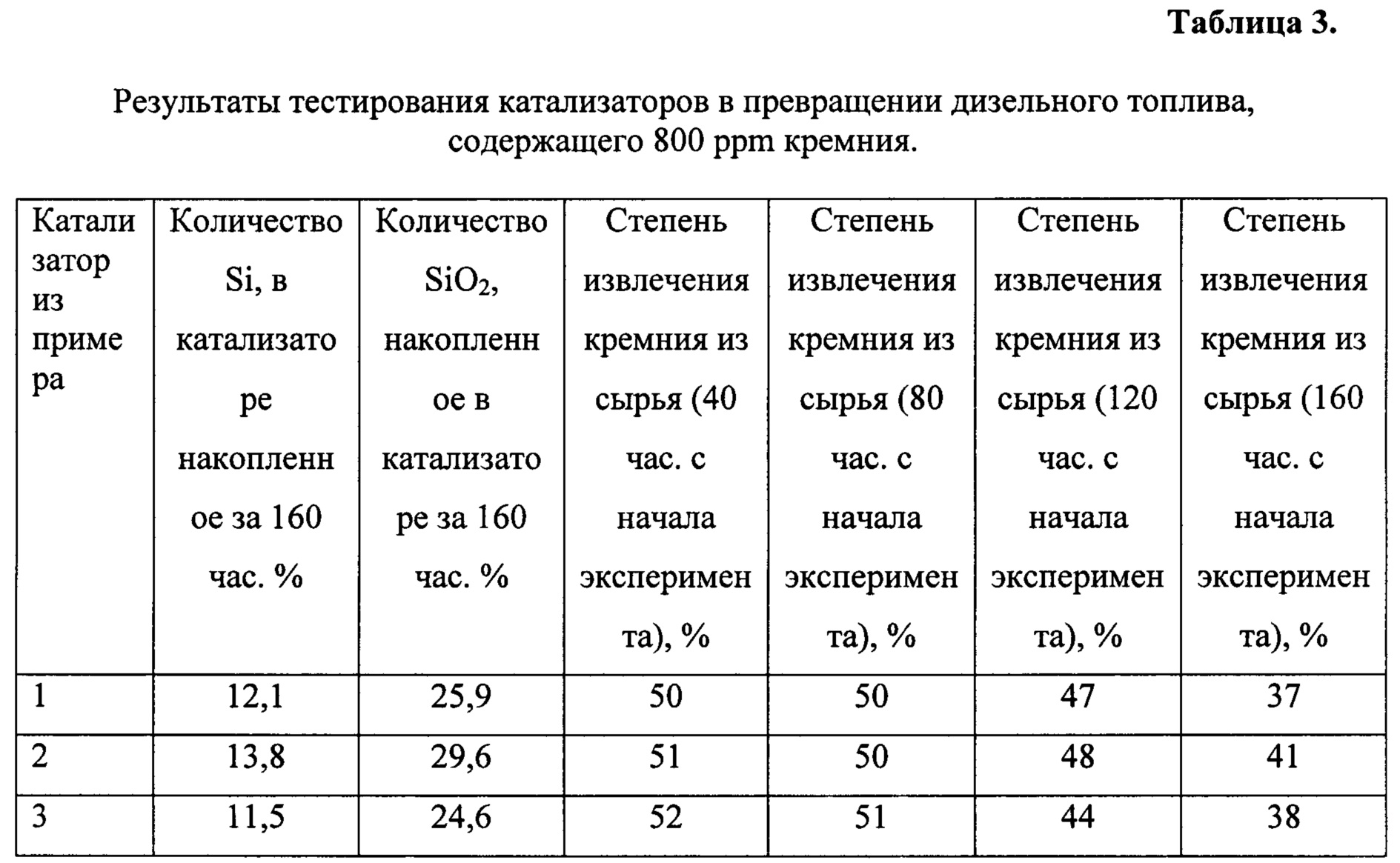
Обычно гетерогенные катализаторы представляют собой твердые соединения, которые добавляют в жидкие или газовые реакционные смеси. Причина, по которой такие катализаторы могут ускорять реакцию, связана с теорией столкновений. Напомним, что согласно теории столкновений, молекулы реагентов должны сталкиваться с правильной ориентацией. По сути, катализатор действует как «гаишник», выравнивая молекулы правильным образом, чтобы им было легче объединяться и реагировать.
Преимущества и недостатки гетерогенного катализа
Гетерогенный катализ имеет ряд преимуществ. Во-первых, гетерогенные катализаторы могут быть отделены от реакционной смеси простым способом, например фильтрацией. Таким образом можно легко и эффективно регенерировать дорогие катализаторы, что является важным фактором для промышленных производственных процессов.
Однако одно ограничение гетерогенного катализа связано с доступной площадью поверхности катализатора.Как только поверхность катализатора полностью насыщена молекулами реагента, реакция не может продолжаться до тех пор, пока продукты не покинут поверхность, и некоторое пространство снова откроется для новой молекулы реагента, чтобы адсорбироваться или присоединяться. По этой причине стадия адсорбции в реакции с гетерогенным катализом часто является стадией ограничения скорости. Несмотря на это, общие преимущества гетерогенного катализа часто перевешивают его недостатки, поскольку катализируемая реакция по-прежнему намного быстрее, чем некаталитическая реакция.
По этой причине стадия адсорбции в реакции с гетерогенным катализом часто является стадией ограничения скорости. Несмотря на это, общие преимущества гетерогенного катализа часто перевешивают его недостатки, поскольку катализируемая реакция по-прежнему намного быстрее, чем некаталитическая реакция.
Гомогенный катализ
Гомогенный катализ — это класс катализа, в котором катализатор занимает ту же фазу, что и реагенты.
Цели обучения
Опишите соответствующие характеристики химических катализаторов
Основные выводы
Ключевые моменты
- Катализаторы можно разделить на два типа: гомогенные и гетерогенные.
- Гомогенные катализаторы занимают ту же фазу, что и реакционная смесь, в то время как гетерогенные катализаторы занимают другую фазу.
- Гомогенные катализаторы обеспечивают большее взаимодействие с реакционной смесью, чем гетерогенные катализаторы.
Ключевые термины
- однородная смесь : однородное по составу вещество.

- катализатор : Вещество, которое увеличивает скорость химической реакции, но не расходуется в процессе.
Катализаторы — это соединения, которые при добавлении в химические реакции снижают энергию активации и увеличивают скорость реакции.Количество катализатора не меняется во время реакции, так как он не расходуется как часть процесса реакции. Катализаторы снижают энергию, необходимую для достижения переходного состояния реакции, позволяя большему количеству молекулярных взаимодействий достичь этого состояния. Однако катализаторы не влияют на степень развития реакции. Другими словами, хотя катализаторы влияют на кинетику реакции, состояние равновесия остается неизменным.
Катализаторы можно разделить на два типа: гомогенные и гетерогенные.Гомогенные катализаторы — это катализаторы, которые находятся в той же фазе (газ или жидкость), что и реагенты, в то время как гетерогенные катализаторы не находятся в той же фазе, что и реагенты. Обычно гетерогенный катализ включает использование твердых катализаторов, помещенных в жидкую реакционную смесь.
Катализ : Обратите внимание на пониженную энергию активации каталитического пути.
Примеры гомогенных катализаторов
Кислотный катализ, металлоорганический катализ и ферментативный катализ являются примерами гомогенного катализа.Чаще всего гомогенный катализ включает введение водной фазы катализатора в водный раствор реагентов. В таких случаях кислоты и основания часто являются очень эффективными катализаторами, поскольку они могут ускорять реакции, влияя на поляризацию связей.
Преимущество гомогенного катализа состоит в том, что катализатор смешивается с реакционной смесью, обеспечивая очень высокую степень взаимодействия между катализатором и молекулами реагента. Однако, в отличие от гетерогенного катализа, гомогенный катализатор часто невозможно восстановить после завершения реакции.
Гомогенные катализаторы используются в различных промышленных приложениях, поскольку они позволяют увеличить скорость реакции без повышения температуры.
Interactive: Catalysis : Модель содержит реагенты, которые будут образовывать реакцию: A₂ + B₂ -> 2 AB. В этом случае модель настроена так, что энергия активации высока. Попробуйте провести реакцию с катализатором или без него, чтобы увидеть влияние катализаторов на химические реакции. 1. Запустите модель, чтобы увидеть, что происходит без катализатора.2. Приостановите модель. 3. Добавьте несколько (3-4) атомов катализатора в контейнер, нажав кнопку. 4. Снова запустите модель и посмотрите, как катализатор влияет на реакцию.
Ферментный катализ
Ферменты — это белки, которые ускоряют биохимические преобразования за счет снижения энергии активации реакций.
Цели обучения
Перечислите пять типичных механизмов, используемых ферментами для катализа биологических реакций
Основные выводы
Ключевые моменты
- Ферменты — это особый класс катализаторов, которые могут ускорять биохимические реакции.

- Ферменты — это белки, которые связывают реагенты или субстраты в областях, называемых активными сайтами.
- При связывании конформационные изменения ферментов приводят к стабилизации комплекса переходного состояния, понижая энергию активации реакции.
Ключевые термины
- субстрат : Реагент (ы), участвующий в биохимической реакции, катализируемой ферментом.
- фермент : глобулярный белок, катализирующий биологическую химическую реакцию.
- активный центр : область внутри фермента, где связывается субстрат.
Синтетические катализаторы используются для ускорения различных промышленных процессов и имеют решающее значение для химической промышленности. Однако катализаторы также встречаются в природе в виде ферментов. Ферменты — это белки, которые способны снижать энергию активации различных биохимических реакций. Они делают это, связывая реагент (ы), известный как субстрат (ы), с активным центром внутри фермента. В активном центре субстрат (ы) может образовывать активированный комплекс с более низкой энергией. После завершения реакции продукт (продукты) покидает активный центр, поэтому фермент может катализировать другие реакции.
В активном центре субстрат (ы) может образовывать активированный комплекс с более низкой энергией. После завершения реакции продукт (продукты) покидает активный центр, поэтому фермент может катализировать другие реакции.
Ферментный катализ : Фермент катализирует биохимическую реакцию, связывая субстрат в активном центре. После того, как реакция протекает, продукты высвобождаются, и фермент может катализировать дальнейшие реакции.
Модель Induced Fit
Одна модель ферментного механизма называется индуцированной моделью соответствия.Эта модель предполагает, что связывание реагента или субстрата с активным сайтом фермента приводит к конформационным изменениям фермента. Это изменение стабилизирует комплекс переходного состояния и, таким образом, снижает энергию активации.
Способы, которыми ферменты катализируют реакции
Ферменты могут катализировать реакции с помощью множества механизмов. Некоторые из них включают:
- Связующий штамм: ферменты могут дестабилизировать связи внутри субстрата.

- Близость и ориентация: конформационные изменения фермента при связывании субстрата могут сблизить реактивные группы или ориентировать их, чтобы они могли реагировать.
- Доноры и акцепторы протонов: присутствие кислотных или основных групп может влиять на поляризацию связей и скорость реакции.
- Электростатический катализ: электростатическое притяжение между ферментом и субстратом может стабилизировать активированный комплекс.
- Ковалентный катализ: ковалентное связывание с боковыми цепями или кофакторами может снизить энергию переходного состояния.
Таким образом, ферменты показывают, что эволюционная биология произвела высокоэффективные катализаторы.
Примеры катализаторов
Иногда химикаты нуждаются в небольшом поощрении, чтобы они могли прореагировать. Термин «катализатор» означает вещество, которое начинает, ускоряет или облегчает химическую реакцию. Похоже, катализаторы можно найти только в химической лаборатории, но вы можете быть удивлены, обнаружив примеры катализаторов в своей повседневной жизни! Продолжайте читать, чтобы узнать, что такое катализатор, и увидеть примеры химических катализаторов, а также примеры катализаторов в нехимическом контексте.
Примеры химических катализаторов
Химический катализатор — это вещество, которое вызывает химическую реакцию, протекающую иначе, чем это произошло бы без этого катализатора. Например, катализатор может вызвать реакцию между реагентами, происходящую с большей скоростью или при более низкой температуре, чем это было бы возможно без катализатора. Существует два основных типа катализаторов: неорганические катализаторы , и органические катализаторы .
Примеры неорганических катализаторов
Неорганические катализаторы — это соединения, не встречающиеся в биологических процессах.В их состав входят элементарные металлы и другие неорганические вещества. Эти катализаторы ускоряют химические реакции, но не изменяют их структуру в процессе. Примеры неорганических катализаторов в химических реакциях включают:
- перманганат калия — Пероксид водорода разлагается на воду и газообразный кислород. Две молекулы перекиси водорода образуют две молекулы воды и одну молекулу кислорода.
 Для ускорения этого процесса можно использовать катализатор перманганат калия.Добавление перманганата калия к перекиси водорода вызовет реакцию с выделением большого количества тепла, и водяной пар выйдет наружу.
Для ускорения этого процесса можно использовать катализатор перманганат калия.Добавление перманганата калия к перекиси водорода вызовет реакцию с выделением большого количества тепла, и водяной пар выйдет наружу.
- платина — Каталитический нейтрализатор в автомобиле содержит платину, которая служит катализатором для превращения токсичного оксида углерода в диоксид углерода.
- палладий — Если вы зажжете спичку в комнате с газообразным водородом и газом кислородом, произойдет взрыв, и большая часть водорода и кислорода объединятся, образуя молекулы воды.
- железо — При производстве аммиака железо является полезным катализатором. Эта реакция, известная как процесс Габера, превращает азот и водород в аммиак. Железо ускоряет разрыв азотных связей, делая его более активным.
- оксид ванадия — Серной кислоте требуется, чтобы диоксид серы превратился в триоксид серы.
 Когда вы пропускаете диоксид серы над оксидом ванадия, он окисляется, то есть добавляет молекулу кислорода — диоксид серы в триоксид серы.
Когда вы пропускаете диоксид серы над оксидом ванадия, он окисляется, то есть добавляет молекулу кислорода — диоксид серы в триоксид серы.
Примеры органических катализаторов
Органические катализаторы известны как «органокатализаторы». Они состоят из неметаллических элементов, таких как углерод, водород и сера. Биокатализаторы, такие как белки и ферменты, представляют собой еще один тип органических катализаторов, участвующих в биохимических процессах. Подобно неорганическим катализаторам, они все еще существуют в своей первоначальной форме после завершения реакции.
- пролин — Пролин — это встречающаяся в природе аминокислота, которая также может быть биосинтезирована.Он действует как катализатор во многих биологических процессах, включая конденсацию альдолов, которая создает углерод-углеродные связи для новых органических соединений.
- диастаза — Когда вы едите что-то, что содержит крахмал, ферменты диастазы являются катализаторами пищеварения.
 Они появляются в слюне и превращают крахмал в мальтозу, которую организм переваривает в желудке.
Они появляются в слюне и превращают крахмал в мальтозу, которую организм переваривает в желудке. - лактаза — У большинства людей в тонком кишечнике есть ферменты лактазы, которые начинают химическое разложение лактозы из молока и молочных продуктов.Люди с непереносимостью лактозы не получают достаточного количества этого фермента и не могут полностью переваривать молочные продукты.
- ДНК-полимераза — Когда ДНК реплицируется, она должна полностью копировать генетическую последовательность. Фермент ДНК-полимераза катализирует синтез ДНК каждый раз, когда клетка делится. Он работает с другими ферментами, включая геликазу и примазу, многократно полностью копируя ДНК.
- щелочная фосфатаза (ЩФ) — Щелочная фосфатаза, обнаруженная в печени, пищеварительной системе и костях, является катализатором расщепления белков.Он также помогает в реакциях, связанных с пищеварением и ростом костей. Слишком много щелочной фосфатазы в крови может указывать на проблему с печенью или костями или может быть просто следствием нормального процесса беременности и кормления грудью.

Нехимические катализаторы
Когда термин «катализатор» используется вне химии, он относится к чему-то, что вызывает социальные изменения или реакции. Это образное определение основано на определении химического катализатора, который запускает большую реакцию.Вот некоторые примеры образных катализаторов:
- отношения — Когда Антония представляет двух своих друзей, которые затем начинают встречаться, она становится катализатором их отношений.
- Изменение законодательства — Член семьи Сьюзен незаконно заключен в тюрьму. Она пишет письма своим депутатам, организует акции протеста и общается со СМИ. Вскоре член ее семьи освобожден, а законы изменены, чтобы предотвратить незаконное заключение кого-либо в тюрьму. Сьюзен была катализатором перемен.
- спорт — Элла сидит на скамейке во время баскетбольного матча. Стартовые игроки устают и отстают по очкам. Тренер Эллы вводит ее в игру.
 Ее энергия помогает ей забивать несколько мячей, и команда побеждает. Элла стала катализатором победы в игре.
Ее энергия помогает ей забивать несколько мячей, и команда побеждает. Элла стала катализатором победы в игре. - Социальные изменения — Барри и его друзья видят, как над младшим ребенком издеваются. Они встают на защиту ребенка и создают группу по борьбе с издевательствами, которая выявляет проблемы с издевательствами на игровой площадке.Вскоре в их школе стало меньше издевательств, и они стали катализатором перемен.
Катализаторы вокруг нас
Эти примеры катализаторов показывают, как одно действие или один человек, как в химии, так и в жизни, могут стать началом больших изменений. Важно помнить, что катализатор только запускает реакцию и что для истинного изменения необходимо больше реагентов. Взгляните на эти повседневные примеры химических реакций, чтобы узнать больше о том, как химия влияет на вашу повседневную жизнь.
Катализатор
Катализатор — это вещество, которое ускоряет скорость химической реакции, но не расходуется в ходе реакции. Катализатор появится на стадиях механизма реакции, но не будет появляться в общей химической реакции (поскольку он не является реагентом или продуктом). Как правило, катализаторы существенно изменяют механизм реакции, так что новые барьеры вдоль координаты реакции значительно ниже.При снижении энергии активации константа скорости значительно увеличивается (при той же температуре) по сравнению с некаталитической реакцией.
Катализатор появится на стадиях механизма реакции, но не будет появляться в общей химической реакции (поскольку он не является реагентом или продуктом). Как правило, катализаторы существенно изменяют механизм реакции, так что новые барьеры вдоль координаты реакции значительно ниже.При снижении энергии активации константа скорости значительно увеличивается (при той же температуре) по сравнению с некаталитической реакцией.
В мире существует множество типов катализаторов. Многие реакции катализируются на поверхности металлов. В биохимии огромное количество реакций катализируется ферментами. Катализаторы могут быть либо в той же фазе, что и химические реагенты, либо в отдельной фазе.
Катализаторы в одной фазе называются гомогенными катализаторами , тогда как катализаторы в разных фазах называются гетерогенными катализаторами.
Например, если у нас есть металлическая Pt в качестве катализатора реакции газообразного водорода и газообразного этена, тогда Pt является гетерогенным катализатором. Однако фермент в растворе, катализирующий биохимическую реакцию в растворе, является гомогенным катализатором.
Однако фермент в растворе, катализирующий биохимическую реакцию в растворе, является гомогенным катализатором.
Еще одна важная идея о катализаторах — их избирательность. То есть катализатор не просто ускоряет все реакции, а только очень конкретную реакцию. Это ключ ко многим химическим превращениям.Когда вы хотите произвести только определенное химическое изменение, вы ищете катализатор, который ускорит эту конкретную реакцию, но не ускорит другие. В этом отношении замечательны ферменты. Живые биологические системы требуют множества специфических химических превращений, и каждый из них катализирует уникальный фермент.
Типы катализаторов
Катализаторы могут находиться либо в той же фазе, что и химические реагенты, либо в отдельной фазе.
Катализаторы в одной фазе называются гомогенными катализаторами, а катализаторы в разных фазах — гетерогенными катализаторами.
Например, если у нас есть металлическая Pt в качестве катализатора реакции газообразного водорода и газообразного этена, тогда Pt является гетерогенным катализатором. Однако фермент в растворе, катализирующий биохимическую реакцию в растворе, является гомогенным катализатором.
Однако фермент в растворе, катализирующий биохимическую реакцию в растворе, является гомогенным катализатором.
Влияние катализаторов
Эффект катализатора заключается в том, что он снижает энергию активации реакции.
Обычно это происходит потому, что катализатор изменяет способ протекания реакции (механизм).Мы можем визуализировать это для простой координаты реакции следующим образом.
В более общем смысле катализируемая реакция может иметь ряд новых барьеров и промежуточных продуктов. Однако самый высокий барьер теперь будет значительно ниже, чем предыдущий самый большой барьер. Например, ниже приведен пример пути реакции, который показывает катализированную и некаталитическую реакцию. Путь с катализатором теперь состоит из двух ступеней и промежуточных частиц. Однако барьеры для обеих стадий намного ниже, чем в некаталитической реакции.
Как работают катализаторы?
Многие катализаторы работают одинаково.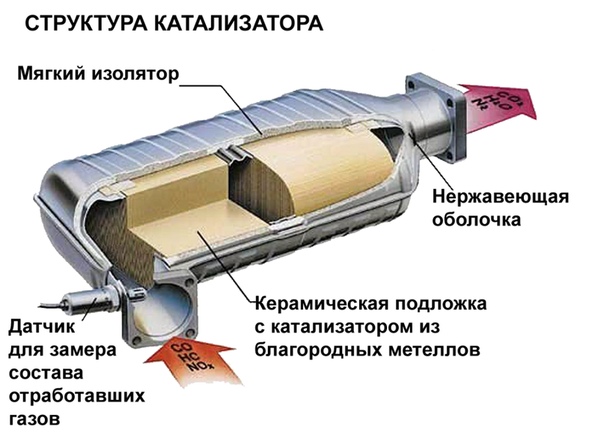 Они позволяют молекулам реагента разрывать связи и затем образовывать временные связи с катализатором. Это означает, что катализатор должен быть в некоторой степени реактивным, но не слишком реактивным (поскольку мы не хотим, чтобы эти связи были постоянными). Например, металлическая Pt служит катализатором многих реакций с участием газообразного водорода или газообразного кислорода. Это связано с тем, что поверхность Pt позволяет H 2 или O 2 разрывать свои связи, а затем образовывать атомные частицы, которые «связаны» с Pt.Однако эти новые связи могут быть достаточно слабыми, чтобы атомные частицы могли затем реагировать с другими молекулами и покидать поверхность. Таким образом, после реакции металл Pt возвращается в свое первоначальное состояние.
Они позволяют молекулам реагента разрывать связи и затем образовывать временные связи с катализатором. Это означает, что катализатор должен быть в некоторой степени реактивным, но не слишком реактивным (поскольку мы не хотим, чтобы эти связи были постоянными). Например, металлическая Pt служит катализатором многих реакций с участием газообразного водорода или газообразного кислорода. Это связано с тем, что поверхность Pt позволяет H 2 или O 2 разрывать свои связи, а затем образовывать атомные частицы, которые «связаны» с Pt.Однако эти новые связи могут быть достаточно слабыми, чтобы атомные частицы могли затем реагировать с другими молекулами и покидать поверхность. Таким образом, после реакции металл Pt возвращается в свое первоначальное состояние.
Например, на рисунке ниже изображена реакция этена и газообразного водорода. Водород приземляется на поверхность и разрывает свою связь с образованием атомов H, связанных с поверхностью (2). Двойная связь этена также разорвана, и два атома углерода также связаны с поверхностью (3). + (водн.) \; + \; O_2 (g)} & {\ rm Шаг \; 2} \\ {\ rm Mn (OH) _2 (aq) \; + \; H_2O_2 (l)} \; & \правая стрелка & \; {\ rm MnO_2 (s) \; + 2H_2O (l)} & {\ rm Шаг \; 3} \ end {array} \]
+ (водн.) \; + \; O_2 (g)} & {\ rm Шаг \; 2} \\ {\ rm Mn (OH) _2 (aq) \; + \; H_2O_2 (l)} \; & \правая стрелка & \; {\ rm MnO_2 (s) \; + 2H_2O (l)} & {\ rm Шаг \; 3} \ end {array} \]
Итак, в чистой реакции нет изменений в MnO 2. Однако во время реакции он превращается в Mn 2+ , а также в Mn (OH) 2 . Катализатор может быть идентифицирован таким образом в механизме реакции, поскольку он сначала появляется в «реагентах», но затем реформируется позже в реакции.
Катализаторы могут также функционировать, «удерживая» молекулы в определенных конфигурациях, одновременно ослабляя некоторые конкретные связи. Это позволяет катализатору существенно «помогать» химии, организуя реакции в благоприятной геометрии, а также ослабляя связи, которые необходимо разорвать по координате реакции.
Ферменты
Ферменты — биологические катализаторы. Это белки, которые складываются в определенные конформации, чтобы ускорить конкретные химические реакции. Для биохимических реакций реагент обычно называют субстратом. Субстрат превращается в продукт. Механизмы многих ферментов очень похожи. Субстрат (ы) и фермент связываются в комплекс. Физическое местоположение на ферменте, в котором связывается субстрат, называется «активным центром».После связывания этот комплекс может затем ослабить определенные связи в субстрате, так что химический процесс образует продукт. Продукт слабо связан с субстратом, так что теперь он диссоциирует, и фермент может свободно связываться с другой молекулой субстрата.
Для биохимических реакций реагент обычно называют субстратом. Субстрат превращается в продукт. Механизмы многих ферментов очень похожи. Субстрат (ы) и фермент связываются в комплекс. Физическое местоположение на ферменте, в котором связывается субстрат, называется «активным центром».После связывания этот комплекс может затем ослабить определенные связи в субстрате, так что химический процесс образует продукт. Продукт слабо связан с субстратом, так что теперь он диссоциирует, и фермент может свободно связываться с другой молекулой субстрата.
Активные центры ферментов могут быть очень специфичными, так что фермент будет катализировать только очень специфическую реакцию для очень специфической молекулы. Обычно существует равновесие между связанным комплексом и свободным субстратом и ферментом, так что связывание может быть обратимым.Напротив, как только продукт образуется, обратной реакции обычно не происходит.
Субстрат + фермент ↔ Комплекс → Продукт.
Активность многих ферментов может блокироваться молекулами, имитирующими субстрат, но не участвующими в химии. Затем эти молекулы эффективно «выключают» фермент, блокируя активный сайт и предотвращая связывание субстрата. Таким образом действуют многие фармацевтические препараты. Такие молекулы обычно называют ингибиторами, поскольку они подавляют активность фермента.
Затем эти молекулы эффективно «выключают» фермент, блокируя активный сайт и предотвращая связывание субстрата. Таким образом действуют многие фармацевтические препараты. Такие молекулы обычно называют ингибиторами, поскольку они подавляют активность фермента.
катализ | Химия, классификация и химические реакции
Катализ , в химии, изменение скорости химической реакции, обычно ускорение, путем добавления вещества, не израсходованного во время реакции. Скорость химических реакций, то есть скорости, с которыми они происходят, зависят от ряда факторов, включая химическую природу реагирующих частиц и внешние условия, которым они подвергаются. Особый феномен, связанный со скоростью химических реакций, который представляет большой теоретический и практический интерес, — это катализ, то есть ускорение химических реакций веществами, не участвующими в самих реакциях, — веществами, известными как катализаторы.Изучение катализа представляет теоретический интерес из-за того, что оно раскрывает фундаментальную природу химических реакций; На практике изучение катализа важно, потому что успех многих промышленных процессов зависит от катализаторов. По сути, это своеобразное явление жизни вряд ли было бы возможным без биологических катализаторов, называемых ферментами.
По сути, это своеобразное явление жизни вряд ли было бы возможным без биологических катализаторов, называемых ферментами.
Наночастицы сплава золото-палладий (желто-синий), нанесенные на обработанный кислотой углерод (серый), непосредственно катализирующие образование пероксида водорода из водорода (белый) и кислорода (красный), при этом предотвращая нежелательное разложение пероксида водорода .
Фотография любезно предоставлена доктором Дэвидом Дж. Уиллоком, Университет Кардиффа В каталитической реакции катализатор обычно вступает в химическую комбинацию с реагентами, но в конечном итоге регенерируется, поэтому количество катализатора остается неизменным. Поскольку катализатор не расходуется, каждая молекула катализатора может вызывать превращение многих молекул реагентов. Для активного катализатора количество молекул, трансформируемых за минуту одной молекулой катализатора, может достигать нескольких миллионов.
Если данное вещество или комбинация веществ подвергаются двум или более одновременным реакциям, которые дают разные продукты, на распределение продуктов может влиять использование катализатора, который избирательно ускоряет одну реакцию относительно другой (й). Путем выбора подходящего катализатора может происходить конкретная реакция, практически исключающая другую. Многие важные применения катализа основаны на такой селективности.
Поскольку обратная химическая реакция может протекать путем обращения стадий, составляющих механизм прямой реакции, катализатор данной реакции одинаково ускоряет реакцию в обоих направлениях.Следовательно, катализатор не влияет на положение равновесия химической реакции; он влияет только на скорость достижения равновесия. Очевидным исключением из этого обобщения являются те реакции, в которых один из продуктов также является катализатором реакции. Такие реакции называют автокаталитическими.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчас
Подпишись сейчасИзвестны также случаи, когда добавление постороннего вещества, называемого ингибитором, снижает скорость химической реакции.Это явление, правильно называемое торможением или замедлением, иногда называют отрицательным катализом. В некоторых случаях концентрации ингибитора могут быть намного ниже, чем у реагентов. Ингибирование может быть результатом (1) снижения концентрации одного из реагентов из-за образования комплекса между реагентом и ингибитором, (2) снижения концентрации активного катализатора («отравления» катализатора) из-за образование комплекса между катализатором и ингибитором или (3) прекращение цепной реакции из-за разрушения носителей цепи ингибитором.
История
Термин катализ (от греческого kata- , «вниз» и lyein , «ослаблять») был впервые использован великим шведским химиком Йенсом Якобом Берцелиусом в 1835 году для сопоставления группы наблюдений, сделанных другими исследователями. химики конца 18 — начала 19 вв. К ним относятся усиленное преобразование крахмала в сахар под действием кислот, впервые обнаруженное Готлибом Сигизмундом Константином Кирхгофом; Наблюдения сэра Хамфри Дэви о том, что платина ускоряет сгорание различных газов; открытие стабильности перекиси водорода в кислотном растворе, но ее разложения в присутствии щелочей и таких металлов, как марганец, серебро, платина и золото; и наблюдение, что окисление спирта до уксусной кислоты осуществляется в присутствии мелкодисперсной платины.Агенты, способствующие этим различным реакциям, были названы катализаторами, и Берцелиус предположил, что в таких процессах действует особая неизвестная каталитическая сила.
К ним относятся усиленное преобразование крахмала в сахар под действием кислот, впервые обнаруженное Готлибом Сигизмундом Константином Кирхгофом; Наблюдения сэра Хамфри Дэви о том, что платина ускоряет сгорание различных газов; открытие стабильности перекиси водорода в кислотном растворе, но ее разложения в присутствии щелочей и таких металлов, как марганец, серебро, платина и золото; и наблюдение, что окисление спирта до уксусной кислоты осуществляется в присутствии мелкодисперсной платины.Агенты, способствующие этим различным реакциям, были названы катализаторами, и Берцелиус предположил, что в таких процессах действует особая неизвестная каталитическая сила.
В 1834 году английский ученый Майкл Фарадей исследовал способность платиновой пластины осуществлять рекомбинацию газообразного водорода и кислорода (продуктов электролиза воды) и замедлять эту рекомбинацию присутствием других газов, таких как этилен и другие газы. монооксид углерода. Фарадей утверждал, что для активности необходима идеально чистая металлическая поверхность (на которой замедляющие газы могут конкурировать с реагирующими газами и, таким образом, подавлять активность), концепция, которая, как позже будет показано, имеет важное значение для катализа.
Многие из примитивных технических искусств включали бессознательное применение катализа. Ферментация вина до уксусной кислоты и производство мыла из жиров и щелочей были хорошо известны в ранней истории человечества. Серная кислота, полученная путем сжигания смесей серы и селитры (нитрата натрия), была ранним предшественником ведущего камерного процесса производства серной кислоты, в котором окисление диоксида серы ускорялось добавлением оксидов азота. (Механизм последнего процесса был предложен сэром Хэмфри Дэви в 1812 году на основе экспериментов, проведенных другими.)
В 1850 году концепция скорости реакции была разработана при изучении гидролиза или инверсии тростникового сахара. Термин инверсия относится к изменению вращения, которому подвергается монохроматический свет, когда он проходит через реакционную систему, параметр, который легко измерить, тем самым облегчая изучение реакции. Было обнаружено, что в любой момент скорость инверсии была пропорциональна количеству тростникового сахара, подвергающегося преобразованию, и что скорость ускорялась присутствием кислот.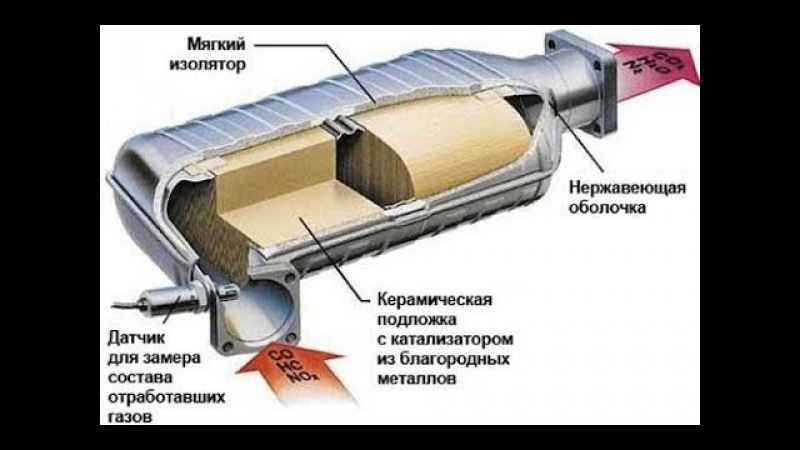 (Позже было показано, что скорость инверсии прямо пропорциональна силе кислоты.) Эта работа была отчасти предвестником более поздних исследований скорости реакции и ускоряющего влияния более высокой температуры на эту скорость, проведенных Дж. Ван’т Хофф, Сванте Аррениус и Вильгельм Оствальд, которые играли ведущие роли в развитии науки физической химии. Работа Оствальда по скоростям реакций привела его в 1890-х годах к определению катализаторов как веществ, которые изменяют скорость данной химической реакции без изменения энергетических факторов реакции.
(Позже было показано, что скорость инверсии прямо пропорциональна силе кислоты.) Эта работа была отчасти предвестником более поздних исследований скорости реакции и ускоряющего влияния более высокой температуры на эту скорость, проведенных Дж. Ван’т Хофф, Сванте Аррениус и Вильгельм Оствальд, которые играли ведущие роли в развитии науки физической химии. Работа Оствальда по скоростям реакций привела его в 1890-х годах к определению катализаторов как веществ, которые изменяют скорость данной химической реакции без изменения энергетических факторов реакции.
Это заявление Оствальда было запоминающимся достижением, поскольку оно подразумевает, что катализаторы не изменяют положение равновесия в реакции. В 1877 году Жорж Лемуан показал, что разложение иодоводородной кислоты до водорода и йода достигло той же точки равновесия при 350 ° C (660 ° F), 19 процентов, независимо от того, проводилась ли реакция быстро в присутствии платиновой губки или медленно в присутствии платиновой губки. газовая фаза. Это наблюдение имеет важное следствие: катализатор прямого процесса в реакции также является катализатором обратной реакции.P.E.M. Бертло, выдающийся французский химик, подтвердил это наблюдение в 1879 году на жидких системах, когда он обнаружил, что реакция органических кислот и спиртов, называемая этерификацией, катализируется присутствием небольших количеств сильной неорганической кислоты, как и наоборот. процесс, гидролиз сложных эфиров (реакция между сложным эфиром и водой).
газовая фаза. Это наблюдение имеет важное следствие: катализатор прямого процесса в реакции также является катализатором обратной реакции.P.E.M. Бертло, выдающийся французский химик, подтвердил это наблюдение в 1879 году на жидких системах, когда он обнаружил, что реакция органических кислот и спиртов, называемая этерификацией, катализируется присутствием небольших количеств сильной неорганической кислоты, как и наоборот. процесс, гидролиз сложных эфиров (реакция между сложным эфиром и водой).
Сознательное применение катализаторов в промышленных процессах было предпринято в 19 веке. Английский химик П. Филлипс запатентовал использование платины для окисления диоксида серы до триоксида серы воздухом.Его способ применяли какое-то время, но от него отказались из-за потери активности платинового катализатора. Впоследствии было установлено, что причиной этого являются яды в реагентах, и этот процесс стал техническим успехом на рубеже 20-го века. В 1871 году был разработан промышленный процесс окисления соляной кислоты до хлора в присутствии солей меди, пропитанных глиняным кирпичом. Полученный хлор использовали в производстве отбеливающего порошка (сухого вещества, выделяющего хлор при обработке кислотой) путем реакции с известью.Опять же, в этой реакции было замечено, что одинаковое равновесие достигалось в обоих направлениях. Кроме того, было обнаружено, что чем ниже температура, тем больше равновесное содержание хлора; рабочая температура 450 ° C (840 ° F) произвела максимальное количество хлора в удобное время.
Полученный хлор использовали в производстве отбеливающего порошка (сухого вещества, выделяющего хлор при обработке кислотой) путем реакции с известью.Опять же, в этой реакции было замечено, что одинаковое равновесие достигалось в обоих направлениях. Кроме того, было обнаружено, что чем ниже температура, тем больше равновесное содержание хлора; рабочая температура 450 ° C (840 ° F) произвела максимальное количество хлора в удобное время.
Ближе к концу XIX века классические исследования выдающегося французского химика Поля Сабатье по взаимодействию водорода с широким спектром органических соединений были выполнены с использованием различных металлических катализаторов; Это исследование привело к разработке немецкого патента на гидрирование жидких ненасыщенных жиров до твердых насыщенных жиров с использованием никелевых катализаторов.Разработка трех важных немецких каталитических процессов оказала большое влияние на промышленность в конце 19 века и в первые десятилетия 20 века. Одним из них был так называемый контактный процесс для каталитического производства серной кислоты из диоксида серы, полученного при плавке.












 Для ускорения этого процесса можно использовать катализатор перманганат калия.Добавление перманганата калия к перекиси водорода вызовет реакцию с выделением большого количества тепла, и водяной пар выйдет наружу.
Для ускорения этого процесса можно использовать катализатор перманганат калия.Добавление перманганата калия к перекиси водорода вызовет реакцию с выделением большого количества тепла, и водяной пар выйдет наружу. Когда вы пропускаете диоксид серы над оксидом ванадия, он окисляется, то есть добавляет молекулу кислорода — диоксид серы в триоксид серы.
Когда вы пропускаете диоксид серы над оксидом ванадия, он окисляется, то есть добавляет молекулу кислорода — диоксид серы в триоксид серы. Они появляются в слюне и превращают крахмал в мальтозу, которую организм переваривает в желудке.
Они появляются в слюне и превращают крахмал в мальтозу, которую организм переваривает в желудке. 
 Ее энергия помогает ей забивать несколько мячей, и команда побеждает. Элла стала катализатором победы в игре.
Ее энергия помогает ей забивать несколько мячей, и команда побеждает. Элла стала катализатором победы в игре.